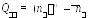- •Глава 2. Молекулы
- •Механическая модель физической молекулы
- •Подходы к построению волновой функции
- •Вопросы для самоконтроля
- •2.1. Метод вс
- •2.1.1. Построение базисного набора
- •2.1.2. Описание молекулы водорода методом вс
- •Симметрия волновой функции
- •Энергетические характеристики молекулы водорода
- •Влияние межъядерного расстояния
- •2.1.3. Общая формулировка метода вс
- •2.1.4. Теория резонанса
- •Вопросы для самоконтроля
- •2.2. Метод мо
- •2.2.1. Молекулярные орбитали
- •Вопросы для самоконтроля
- •2.2.2. Описание молекулы водорода методом мо
- •Вычисление энергии в методе мо
- •Орбитальные энергии
- •Конфигурационное взаимодействие
- •2.2.3. Общая формулировка метода мо
- •Канонические мо
- •Локальные характеристики молекулы в методе кмо
- •Электронная плотность атомов
- •Порядок химической связи
- •Индекс свободной валентности
- •Молекулярные диаграммы
- •Поляризуемости
- •Вопросы для самоконтроля
- •2.2.4. Метод мо Хюккеля
- •Молекула этилена
- •Молекула циклобутадиена
- •Общие решения в методе Хюккеля
- •Молекулы с гетероатомами в методе мох
- •Система параметров Стрейтвизера
- •Вопросы для самоконтроля
- •2.2.5. Метод лмо
- •Гибридизация ао
- •Эффекты сопряжения
- •Индуктивные эффекты
- •Вопросы для самоконтроля
- •2.3. Ядерный остов молекул
- •Вопросы для самоконтроля
- •2.4. Спиновые состояния ядерного остова
- •Вопросы для самоконтроля
- •Рекомендуемая литература Основная
- •Дополнительная
- •Типовые задачи
Канонические мо
Молекулярные орбитали, находимые как решения ХФР-уравнений, называются каноническими(КМО). Их отличительная черта — полная делокализованность. Другими словами, каждая КМО распространяется на всю молекулу в целом, что отражает тот факт, что любой электрон молекулы может быть найден в любой точке внутри молекулярного объема.
КМО, помимо их энергии, могут быть охарактеризованы с пространственной точки зрения, аналогично атомным орбиталям. Наиболее важными из пространственных характеристик КМО являются две. Первой из них является узловая структура, т.е. совокупность узловых поверхностей, разделяющих объем молекулы на отдельные фрагменты, и на которых вероятность обнаружения электрона равна нулю. Здесь выполняется общее квантовомеханическое правило — число узлов пропорционально орбитальной энергии. Вторая характеристика КМО —пространственная симметрия, которую можно описать, указав неприводимое представление (тип симметрии) точечной группы молекулы; например, все КМО молекулы воды должны иметь один из четырех типов симметрии группы С2v, а все КМО молекулы метана — один из пяти типов симметрии группыTd. Для иллюстрации можно привести четыре КМО-типа молекулы цис-бутадиена, форма которых изображена на рисунке (заштрихованные области соответствуют отрицательным значениям МО):
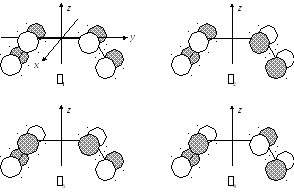
Из рисунка видно, что все четыре МО имеют узловую поверхность, совпадающую с плоскостью yzи обусловленную характером исходных АО (р-тип). Вторая МО имеет дополнительную узловую поверхность, перпендикулярную плоскостиyz, в которой расположены ядра молекулы. Она проходит между атомами 2‑3. Третья МО имеет две (между атомами 1‑2 и 3‑4), а четвертая МО — три (между атомами 1‑2, 2‑3 и 3‑4) дополнительные поверхности. Легко видеть, что симметрия этих КМО описывается неприводимыми представлениями точечной группы С2v: первая и третья КМО принадлежат к типу В2(антисимметричны относительно операции С2zи симметричны относительно отраженияxz), а вторая и четвертая — к типу А2(симметричны относительно операции С2zи антисимметричны относительно отраженияxz).
Локальные характеристики молекулы в методе кмо
Знание коэффициентов МО позволяет вычислять ряд полезных характеристик молекул, имеющих локальный характер (т.е. отнесенных к отдельным фрагментам в составе молекулы). Расчет основан на матричном представлении коэффициентов КМО:
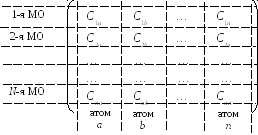
Каждая строка матрицы коэффициентов соответствует определенной КМО, т.е. некоторому электрону. Каждый столбец матрицы соответствует определенному атому молекулы, и коэффициенты, входящие в этот столбец, показывают вклад отдельных электронов в свойства данного атома. В частности, квадрат коэффициента Сikдает вероятность нахожденияi-го электрона в окрестности атома с номеромk, или, другими словами, электронную плотность на атоме с номеромk, создаваемуюi-м электроном.
Электронная плотность атомов
Для расчета полной электронной плотности атома следует просто просуммировать такие плотности по всем электронам молекулы. Отсюда получается простая формула:
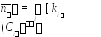
где Ci— коэффициент МО с номеромiпри атоме с номером,
ki— заселенность данной МО (число электронов, равное 0, 1 или 2).
Кроме средней электронной плотности, рассчитываемой по данной формуле, каждый атом можно охарактеризовать еще одним числом no, которое равно числу электронов, поставляемых данным атомом в общую электронную оболочку молекулы. Тогда разность между этим числом и реальной электронной плотностью будет представлять собой избыточный электрический заряд, локализованный в области пространства молекулы, занимаемой данным атомом: