
- •Глава 2. Молекулы
- •Механическая модель физической молекулы
- •Подходы к построению волновой функции
- •Вопросы для самоконтроля
- •2.1. Метод вс
- •2.1.1. Построение базисного набора
- •2.1.2. Описание молекулы водорода методом вс
- •Симметрия волновой функции
- •Энергетические характеристики молекулы водорода
- •Влияние межъядерного расстояния
- •2.1.3. Общая формулировка метода вс
- •2.1.4. Теория резонанса
- •Вопросы для самоконтроля
- •2.2. Метод мо
- •2.2.1. Молекулярные орбитали
- •Вопросы для самоконтроля
- •2.2.2. Описание молекулы водорода методом мо
- •Вычисление энергии в методе мо
- •Орбитальные энергии
- •Конфигурационное взаимодействие
- •2.2.3. Общая формулировка метода мо
- •Канонические мо
- •Локальные характеристики молекулы в методе кмо
- •Электронная плотность атомов
- •Порядок химической связи
- •Индекс свободной валентности
- •Молекулярные диаграммы
- •Поляризуемости
- •Вопросы для самоконтроля
- •2.2.4. Метод мо Хюккеля
- •Молекула этилена
- •Молекула циклобутадиена
- •Общие решения в методе Хюккеля
- •Молекулы с гетероатомами в методе мох
- •Система параметров Стрейтвизера
- •Вопросы для самоконтроля
- •2.2.5. Метод лмо
- •Гибридизация ао
- •Эффекты сопряжения
- •Индуктивные эффекты
- •Вопросы для самоконтроля
- •2.3. Ядерный остов молекул
- •Вопросы для самоконтроля
- •2.4. Спиновые состояния ядерного остова
- •Вопросы для самоконтроля
- •Рекомендуемая литература Основная
- •Дополнительная
- •Типовые задачи
Вопросы для самоконтроля
1. Каковы основные отличия метода локализованных молекулярных орбиталей (ЛМО) от полного варианта метода МО ЛКАО? Какой из этих вариантов лучше соответствует представлениям классической теории строения молекул и теории Льюиса?
2. Как ЛМО классифицируются по энергии и пространственной симметрии? Охарактеризуйте каждый класс (тип) ЛМО.
3. Какие способы перекрывания АО называются "эффективными" и "неэффективными"? Почему?
4. В чем заключается смысл процедуры "гибридизации"? Для каких целей она используется?
5. Чем различаются гибридные и шаровые АО? Какова связь между ними?
6. Перечислите основные разновидности гибридизации. Для каких молекул может использоваться каждая из них?
7. Дайте определение понятий "мезомерный эффект", "эффект сопряжения", "индуктивный эффект". Как эти эффекты можно оценить количественно? Какие выводы о реакционной способности молекулы можно сделать на основании наличия этих эффектов?
8. Перечислите основные типы сопряжения. Как тип сопряжения связан с химическим строением (структурной формулой) молекулы?
2.3. Ядерный остов молекул
Наиболее существенным отличием молекул от атомов является наличие нескольких атомных ядер, составляющих, в совокупности ядерный остов молекулы. Относительное расположение ядер в пространстве можно задать совокупностью межъядерных расстояний {rij}. Ядра молекулы не закреплены какими-либо жесткими связями и могут перемещаться относительно друг друга, так что межъядерные расстояния оказываются переменными величинами. Для описания всех возможных состояний ядерного остова удобно использовать т.н. "конфигурационное пространство" (КП), координатным осям в котором соответствуют отдельные межъядерные расстояния. Каждая точка КП изображает некоторую конкретнуюпространственную конфигурациюядерного остова молекулы. Например, для трехядерной молекулы воды КП будет совпадать с обычным трехмерным евклидовым пространством:

Знание конфигурации молекулы важно в том отношении, что от межъядерных расстояний зависит характер движения электронов и, следовательно, суммарная электронная энергия молекулы Еэл. Кроме того, электрические заряды ядер порождают кулоновские силы отталкивания между ними, с которыми связан еще один вклад в полную энергию молекулы —Еяд. Эта ядерная энергия также зависит от межъядерных расстояний. В результате можно определить функцию:Е=Еэл+Еяд=f(rij), которая является важной характеристикой любой молекулы. Она называетсяповерхностью потенциальной энергии (ППЭ). Ее значения для любой заданной конфигурации можно вычислить методами ВС и МО (см. разделы 2.1.2. и 2.2.2.).
ППЭ имеет весьма сложную форму, основной особенностью которой является наличие одного или нескольких минимумов (потенциальных ям). Каждый минимум соответствует некоторой устойчивой конфигурациимолекулы. Координаты минимума в КП определяютгеометрическую формумолекулы. Если минимумов несколько, то это означает, что молекула может существовать в виде несколькихизомерных структур, каждая из которых характеризуется своей формой. Знание геометрических форм молекул необходимо для определения их пространственной симметрии (ТГС) и оценки реакционной способности.
Для самых простых молекул ППЭ можно наглядно представить в графическом виде. Например, для двухатомных молекул конфигурационное пространство одномерно и представляет собой единственную координатную ось r. Соответственно, графиком ППЭ является одномерная криваяE=f(r) на плоскости с координатной системой "Е—r". (Примеры таких графиков для молекулы водорода приведены выше в разделах 2.1.2 и 2.2.2.) В более сложных случаях ППЭ многомерна и непосредственное ее графическое представление невозможно. Обойти эту трудность можно с использованиемэнергетических профилей, которые представляют собой сечения ППЭ плоскостями (в общем случае, двумерными поверхностями), содержащими две координатные оси. Одна из осей соответствует энергии молекулы, а другая — одному из межъядерных расстояний или комбинации нескольких межъядерных расстояний.
С помощью энергетических профилей ППЭ можно решать ряд важных химических задач, касающихся строения молекул и их химических свойств.
Если выбрать в КП определенную точку (конфигурацию), то для нее можно исследовать энергетические профили, соответствующие изменению всех межъядерных расстояний. При этом оказывается, что все эти профили можно отнести к одному из двух стандартных типов — I или II.

Соответственно, все пары ядер молекулы можно также подразделить на два типа: химически несвязанные(энергетический профиль I типа) ихимически связанные(энергетический профиль II типа). Если ядра изобразить точками и точки, соответствующие связанным парам ядер, соединить линиями, получится графический образ молекулы, называемыйтопологическим графом. Разновидностью таких графов являются известные структурные формулы классической химии. Таким образом, знание ППЭ позволяет эффективно решать важную химическую задачу — устанавливать для любой молекулы классическую структурную формулу.
С помощью топологического графа для определенной совокупности атомных ядер и электронов можно определить важную характеристику — химическую форму(ХФ). Любой ХФ соответствует некоторая определенная область КП. Все точки (конфигурации), принадлежащие этой области, характеризуется одним и тем же топологическим графом.
Например, для линейной трехъядерной системы (A BC) КП двумерно и его можно изобразить на плоскости. Если ядра А, В и С соответствуют одновалентным атомам, то в КП имеются две области, соответствующие двум химическим формам. В форме I система существует в виде молекулы ВС и отдельного атома А. В форме II та же самая систем существует в виде молекулы АВ и отдельного атома С.

Переход через границу раздела между двумя разными ХФ соответствует некоторому химическому превращению, в ходе которой меняется топология или связность системы (одни химические связи исчезают, а другие появляются). Совокупность таких химических форм и химических превращений для некоторой ядерно-электронной системы удобно изображать с помощью специального "конфигурационного графа", в котором вершины соответствуют химическим формам, а ребра — химическим реакциям.
Если проанализировать одно из ребер такого графа с помощью ППЭ, то можно заключить, что химическое превращение должно осуществляться с наименьшими энергетическими затратами. Тогда ему будет соответствовать некоторая кривая в КП, соединяющая две устойчивые конфигурации, принадлежащие разным химическим формам. Такая кривая называется траекторией иликоординатой реакции. (Сплошными линиями на рисунке изображены уровни постоянной энергии.)
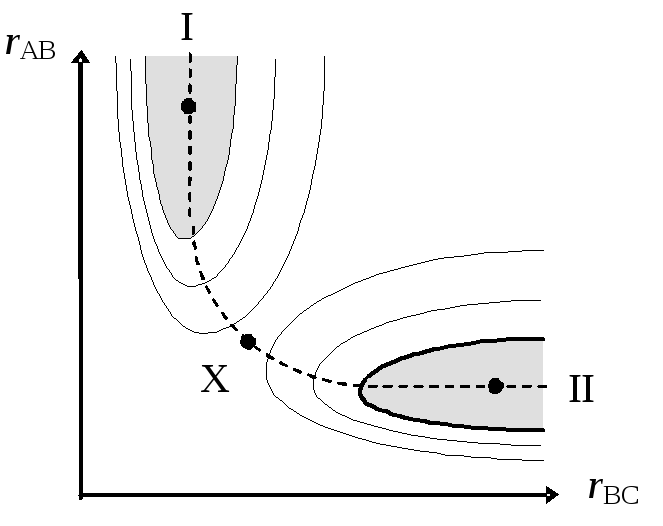
Построив вдоль этой траектории поверхность, параллельную оси энергии, можно получить специальный энергетический профиль — профиль элементарного акта(ЭА) химического превращения.

На таком профиле всегда имеются два минимума, соответствующие двум устойчивым состояниям — начальному (I) и конечному (II). Разность энергий этих минимумов представляет собой важную характеристику ЭА — энергетический эффект(Е), который можно использовать для оценки энергетических эффектов (Н) макроскопических химических процессов.
Кроме того, относительные глубины минимумов определяют собой положение химического равновесия. Используя модель канонического ансамбля (см. [1]), можно получить константу равновесия в виде отношения заселенностей двух химических форм:
K=NII/NI = exp(–EII/kT)/exp(–EI/kT) = exp(–Е/kT)
Между минимумами химических форм всегда находится разделяющий их энергетический барьер, высота которого существенно влияет на скорость химического превращения. Для преодоления барьера молекулы исходной химической формы (I) должны получить извне порцию энергии, равнуюI, которая называетсяэнергией активацииЭА. При протекании ЭА в обратную сторону энергия активации будет равнаII. Как правило, эта энергия заимствуется реагирующими молекулами из термостата. В этом случае с помощью фактора Больцмана можно оценить вероятность превращения, пропорциональную константе скорости реакции k:
РIII~k~ exp(–/kT)
Легко видеть, что данное выражение качественно совпадает с известным уравнением Аррениуса, установленным экспериментально.
В заключение этого раздела следует отметить, что знание формы ППЭ позволяет с помощью модели "гармонического осциллятора" (см. [3]) описывать особый вид внутренних механических движений — колебания ядерного остова молекулы. Колебательные степени свободы молекул играют важную роль в их описании, так как благодаря им, молекулы оказываются способными захватывать из окружающей среды (термостата) определенное количество термической энергии, которая инициирует химические превращения. Можно сказать, что любое химическое превращение молекулы представляет одно из колебаний ядер, амплитуда которого превысила некоторую критическую величину.
Колебательные квантовые переходы молекул легко наблюдать экспериментально в инфракрасной (ИК) области электромагнитного спектра. Их изучение лежит в основе одного из наиболее информативных методов исследования молекул — ИК-спектроскопии, с помощью которого можно эффективно решать задачи идентификации молекул и установления их химического строения.
