
- •Глава 2. Молекулы
- •Механическая модель физической молекулы
- •Подходы к построению волновой функции
- •Вопросы для самоконтроля
- •2.1. Метод вс
- •2.1.1. Построение базисного набора
- •2.1.2. Описание молекулы водорода методом вс
- •Симметрия волновой функции
- •Энергетические характеристики молекулы водорода
- •Влияние межъядерного расстояния
- •2.1.3. Общая формулировка метода вс
- •2.1.4. Теория резонанса
- •Вопросы для самоконтроля
- •2.2. Метод мо
- •2.2.1. Молекулярные орбитали
- •Вопросы для самоконтроля
- •2.2.2. Описание молекулы водорода методом мо
- •Вычисление энергии в методе мо
- •Орбитальные энергии
- •Конфигурационное взаимодействие
- •2.2.3. Общая формулировка метода мо
- •Канонические мо
- •Локальные характеристики молекулы в методе кмо
- •Электронная плотность атомов
- •Порядок химической связи
- •Индекс свободной валентности
- •Молекулярные диаграммы
- •Поляризуемости
- •Вопросы для самоконтроля
- •2.2.4. Метод мо Хюккеля
- •Молекула этилена
- •Молекула циклобутадиена
- •Общие решения в методе Хюккеля
- •Молекулы с гетероатомами в методе мох
- •Система параметров Стрейтвизера
- •Вопросы для самоконтроля
- •2.2.5. Метод лмо
- •Гибридизация ао
- •Эффекты сопряжения
- •Индуктивные эффекты
- •Вопросы для самоконтроля
- •2.3. Ядерный остов молекул
- •Вопросы для самоконтроля
- •2.4. Спиновые состояния ядерного остова
- •Вопросы для самоконтроля
- •Рекомендуемая литература Основная
- •Дополнительная
- •Типовые задачи
Вопросы для самоконтроля
1. Как вычислить глобальную энергию молекулы в методе МО? Из каких составляющих она складывается? Каков физический смысл орбитальных энергий, кулоновских и резонансных поправок?
2. Чем кулоновские и резонансные поправки в методе МО отличаются от аналогичных поправок в методе ВС?
3. На какие составляющие можно разложить орбитальную энергию? В чем физический смысл остовных и резонансных интегралов? Как связаны величины остовных и резонансных интегралов с химическими характеристиками молекулы и составляющих ее атомов?
4. Что представляет собой "корреляционная диаграмма"? Какую информацию о свойствах молекулы можно извлечь из этой диаграммы?
5. Что представляет собой "конфигурационное взаимодействие"? Каковы причины, вызывающие необходимость его учета? Каким образом этот учет производится?
6. Опишите в общем виде метод Хартри-Фока-Рутана. Какую роль в этом методе играет вариационный принцип?
7. Чем полуэмпирические варианты метода ХФР отличаются от неэмпирических?
8. Какие локальные характеристики молекулы можно вычислить, зная матрицу коэффициентов МО? Для решения каких химических задач можно использовать эти характеристики?
9. Что представляет собой "молекулярная диаграмма"? Какая информация о строении молекулы отображается на ней?
10. Какие особенности молекулы отражаются "поляризуемостями"? Для решения каких химических задач можно использовать поляризуемости разных типов?
2.2.4. Метод мо Хюккеля
Для иллюстрации практического применения метода КМО рассмотрим подробно один из его простых вариантов, разработанный Хюккелем. Метод Хюккеля (МОХ) является одним из наиболее простых и полезных вариантов общего метода МО. В его основе лежит несколько приближений, позволяющих практически полностью избавиться от вычислительных трудностей.
Метод Хюккеля имеет дело с каноническими МО и поэтому каждая хюккелевская МО строится в виде ЛКАО:
i=Сi +Сi + . . . +Сi + . . . + in n
где i— номер МО,,, … — номера АО, аn— число атомов.
Как указано выше, система уравнений Хартри-Фока-Рутана (ХФР) для нахождения коэффициентов МО (Сi) имеет вид:

где F— матричные элементы оператора Фока (характеризующие энергию взаимодействия пары атомов с номерамии),S — интегралы перекрывания для данной пары атомов, а— энергия МО с коэффициентами {С,С, …. ,Сn}.
Основные проблемы метода МО, как известно, связаны с необходимостью процедуры самосогласования, включающей многократные вычисления интегралов типа FиS. В методе Хюккеля ни один из этих интегралов не вычисляется — они определяются на основании экспериментальных данных (спектральные, калориметрические и т.д.). Таким образом МОХ относится к большой группеполуэмпирическихвариантов метода МО.
Еще одно приближение метода Хюккеля заключается в том, что все диагональные интегралы F (оба индекса одинаковы), характеризующие некоторый атом (точнее, энергию электрона, локализованного на этом атоме), полагаются одинаковыми и поэтому обозначаются одним и тем же символом: F = F =(кулоновскийинтеграл). Другими словами, предполагается, что все атомы, входящие в состав молекулы, одинаковы по химической природе и все атомные орбитали () из которых строятся хюккелевские МО относятся к одному типу. Именно поэтому простой метод МОХ применяется почти исключительно для описания ненасыщенных углеводородов типа полиенов и аренов. Обычно используют АОpz-типа принадлежащие атомам углерода; построенные из них МО относятся к‑типу:
= С (pz)+С (pz)+ . . . +С (pz)+ . . . +Сn (pz)n
(Отмеченное ограничение несущественно для решения химических задач, так как реакционная способность молекул, содержащих -электроны, обусловлена электронами именно этого типа. Дополнительно можно отметить, что известны усовершенствованные разновидности метода МОХ, позволяющие описывать электроны и других типов.).
Третье приближение сводится к тому, что недиагональные интегралы Fразделяются на два типа. Первый тип относится к парам атомов, между которыми имеется химическая связь. Для таких пар атомов принимается следующее условие:F=(резонансныйинтеграл). Второй тип относится к несвязанным химически парам атомов. Для нихF= 0. Резонансный интеграл представляет собой поправку к полной энергии, обусловленную делокализацией электрона за счет его перехода от атомак атому, и наоборот. Химически связанные атомы располагаются близко друг к другу и амплитуда обмена электронами для такой пары атомов велика. Химически несвязанные атомы практически не могут обмениваться электронами напрямую и соответствующая поправка к энергии настолько мала, что ею можно пренебречь. Следует подчеркнуть, что разделение недиагональных интеграловF на два типа осуществляется исключительно на химической основе — по структурной формуле молекулы. Можно сказать, что структура матрицы уравнений ХФР в методе Хюккеля определенным образом "приспособлена" к топологии молекулы. Поэтому метод МОХ относится к классу т.н.топологическихвариантов МО.
Четвертое приближение заключается в том, что интегралы перекрывания Sтакже разделяются на два типа: диагональные интегралы приравниваются к 1, а недиагональные к 0:
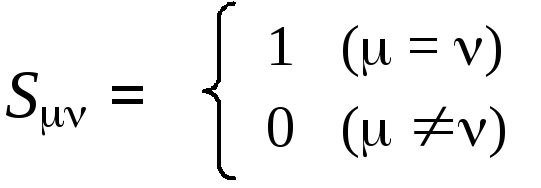
Такой подход называется приближением нулевого дифференциального перекрывания(НДП).
После сделанных приближений, матрица уравнений ХФР существенно упрощается — она уже не содержит интегралов (типа FиS), которые надо вычислять итерационным методом ССП, а содержит только небольшое число константи, значения которых предполагаются заранее известными, а также параметр. Поэтому интегро-дифференциальная система уравнений ХФР превращается в методе МОХ в обычную систему уравнений, которую можно легко решить методами линейной алгебры.
Эта система имеет следующий вид: по диагонали матрицы стоят числа (–), а недиагональные элементы равны либо числу, либо или нулю, в зависимости от топологии (структурной формулы) молекулы. С целью упрощения, можно провести дополнительное преобразование: разделим все элементы матрицы на. Тогда диагональные элементы приобретут вид (–)/= х, а недиагональные будут равны или 0/= 0, или/= 1:
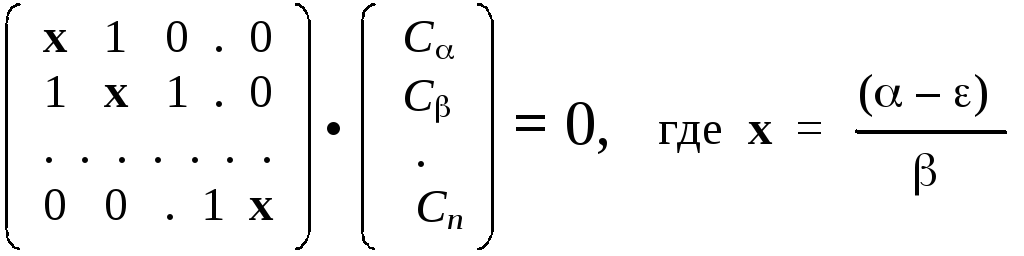
Эта система является однородной(все правые части равны 0). Такие системы совместны только тогда, когда определитель системы равен нулю.

Раскрыв этот определитель, получим характеристическое уравнение, имеющееnкорней {x1,x2, . . . ,xn}. При поочередной подстановке их в систему, получаетсяnэкземпляров системы, причем все они будут заведомо совместны (разрешимы). В качестве решения каждая такая система будет давать набор коэффициентов для одной из МО. Энергии соответствующих МО легко вычислить через значения корней:i=–хi . Этим и исчерпывается общая схема решения хюккелевской задачи.
Для иллюстрации рассмотрим несколько простых примеров.
