
химия + методичка / theory
.pdfщенную в 1М раствор H2SO4. Через этот раствор под давлением 1атм при температуре 25ºС пропускают газообразный водород.
Водород в большом количестве адсорбируется (поглощается) мелкораздробленной платиной, в результате чего металлическая поверхность уподобляется поверхности твёрдого водорода. Газообразный водород, растворенный в платине, частично диссоциирует на атомы в результате каталитического процесса, и в поверхностном слое такого электрода устанавливается равновесие:
H 2 ↔ 2H |
(8.3) |
В свою очередь, на границе электрод – раствор возникает равновесие:
H ↔ H + |
+ |
e |
(8.4) |
раствор |
|
электрод |
|
Т.е. возникает разность потенциалов, которую называют потен-
циалом стандартного водородного электрода и условно принимают за нуль.
Измерение стандартных электродных потенциалов ( EM0 е / Mеn+ ):
Для измерения EM0 е / Mеn+ составляют цепь, в которой одним
электродом является стандартный водородный электрод, а другим электродом – изучаемый металл, погружённый в раствор свой соли концентрацией 1 моль/л (t = 25°C ). По показанию гальванометра су-
дят о величине EM0 е / Mеn+ .
8.3. Электрохимический ряд напряжений
Стандартный электродный потенциал является очень важной характеристикой свойств металла.
По химической активности (в растворах), которая может быть количественно оценена величиной EM0 е / Mеn+ , металлы располагаются в
ряд в порядке возрастания EM0 е / Mеn+ , называемый рядом напряжений (см. таблицу).
Таблица 8.1.
Ряд напряжений металлов
151
|
|
|
|
|
|
Электрод |
E0, В |
Электрод |
E0, В |
Электрод |
E0, В |
|
|
|
|
|
|
Li/Li+ |
-3,02 |
Zn/Zn2+ |
-0,76 |
Sb/Sb2+ |
0,20 |
Ba/Ba2+ |
-2,96 |
Cr/Cr3+ |
-0,74 |
Bi/Bi3+ |
0,30 |
K/K+ |
-2,92 |
Fe/Fe2+ |
-0,44 |
Cu/Cu2+ |
0,34 |
Ca/Ca2+ |
-2,87 |
Cd/Cd2+ |
-0,40 |
Ag/Ag+ |
0,80 |
Na/Na+ |
-2,71 |
Co/Co2+ |
-0,28 |
Hg/Hg2+ |
0,86 |
Mg/Mg2+ |
-2,36 |
Ni/Ni2+ |
-0,25 |
Pt/Pt2+ |
1,19 |
Al/Al3+ |
-1,66 |
Sn/Sn2+ |
-0,14 |
Au/Au3+ |
1,50 |
Ti/Ti2+ |
-1,63 |
Pb/Pb2+ |
-0,13 |
|
|
Mn/Mn2+ |
-1,18 |
H2/2H+ |
0,00 |
|
|
Свойства ряда напряжений:
1.Чем меньше алгебраическая величина EM0 е / Mеn+ , тем боль-
ше способность атомов металла, погружённого в раствор, отдавать электроны, т.е. тем больше химическая активность металла. Значит, самый сильный восстановитель – Li, а самый сильный окислитель – Au.
2. Каждый металл ( не разлагающий воду ) способен вытеснить ( восстановить ) из растворов солей только те металлы, которые стоят после него в ряду напряжений, т.е имеют большую ал-
гебраическую величину EM0 е / Mеn+ .
Zn + CuSO4 = ZnSO4 + Cu
Cu + ZnSO4 ¹
3. Водород может быть вытеснен (восстановлен) из растворов разбавленных кислой (кроме HNO3) только теми металлами,
которые имеют отрицательную величину EM0 е / Mеn+ , т.е. стоят до водорода в ряду напряжений:
Zn + H2SO4 ( разб.) = ZnSO4 + H2 −
Cu + H2SO4 ( разб.) ¹
Здесь необходимо отметить, что положение металлов в ряду напряжений не вполне соответствует их положению в Периодической
системе. Это объясняется тем, что при измерении EM0 е / Mеn+ учитывается не только энергия отрыва электронов от отдельных изолирован-
152

ных атомов, но и энергия, которая тратится на разрушение кристаллической решётки, а также энергия, которая выделяется при гидратации ионов.
Например, в соответствии с положением в Периодической системе натрий Na – более активный металл, чем литий Li. Однако
ELi0 / Li + < ENa0 / Na + , т.е. в водных растворах литий проявляет большую восстановительную активность, чем натрий. Это объясняется тем, что энергия гидратации ионов Li+ значительно больше энергии гидратации ионов Na+, поэтому процесс образования гидратированных ионов атома лития:
Li+ × e + mH2O ® Li+ × mH2O + e
является энергетически более выгодным, чем процесс образования гидратированных ионов натрия.
8.4. Уравнение Нернста
Как отмечалось, EM0 е / Mеn+ определены для металлов, погружён-
ных в одномолярные растворы своих солей.
Если же концентрация раствора отличается от одномолярной, то электродные потенциалы в этом случае подсчитывают по урав-
нению Нернста, которое в окончательном варианте имеет вид:
|
|
EMе / Mеn+ |
= EM0 |
е / Mеn+ |
+ |
0,059 lg[Men+ ] |
, |
(8.5) |
|
|
|
|
|
|
n |
|
|
где: |
E0 |
n+ – стандартный электродный потенциал металла; n – ва- |
||||||
|
Mе / Mе |
|
|
|
|
|
|
|
лентность металла; [ Men+ ] – концентрация раствора соли металла (моль/л).
Пример: Определить электродный потенциал цинковой пластинки, погруженной в 0,001М раствор ZnSO4:
EZn / Zn2+ = EZn0 / Zn2+ + 0,0592 ×lg10−3
EZn / Zn2+ = -0,76 + 0,0592 × (-3) = -0,849B
8.5. Основы теории гальванических элементов
153
Гальванический элемент – это система, в которой химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию.
Мы уже отмечали выше, что при погружении металла в водный раствор быстро устанавливается равновесие:
Me0 ↔ Men+ + ne |
(8.2) |
раствор металл
Это равновесие может быть нарушено двояко:
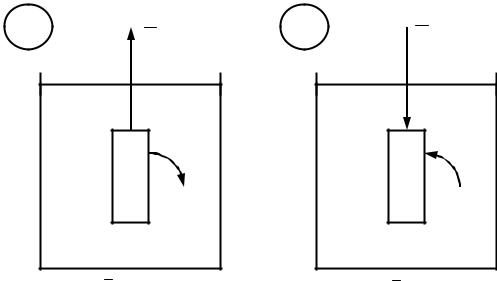
а) путём удаления из металла (например Zn) электронов, что вызывает смещение равновесия вправо, т.е. растворение металла (рис. 8.5, а)
б) Если же, напротив, извне подводить электроны к металлу, то равновесие смещается влево, т.е. на металле будут оседать (восстанавливаться) его катионы, находящиеся в растворе (рис. 8.5 б).
a
e
раб
)
e
Zn2+
ZnSO4 → Zn2+ + SO42−
Zn0 − 2e = Zn 2+
Zn2+
ZnSO4 → Zn2+ + SO42−
Zn2 + + 2e = Zn0
Рис. 8.5. а – удаление электронов из металла, б – подведение электронов к металлу.
Такие процессы наблюдаются при работе гальванических элементов.
154

8.5.1. Медно-цинковый гальванический элемент (элемент Дани- эля-Якоби)
Возьмём два сосуда, в один из них, содержащий 1М раствор сульфата цинка ZnSO4, опустим цинковый электрод; в другой, заполненный
1М раствором сульфата меди CuSO4 – медный электрод (рис. 8.6). Состояние равновесия для электродов выражается уравнением:
ì |
0 |
« Zn |
2+ |
+ 2e |
(8.6) |
||
ïZn |
|
|
|
|
|||
í |
|
0 |
|
|
2+ |
|
|
ï |
|
« Cu |
+ 2e |
(8.7) |
|||
îCu |
|
|
|||||
Направление тока
е
← SO42−
е |
|
е |
–
- Zn2+ +
-
К |
+ |
– |
– + |
+ – |
– + |
|
|
||||||
|
+ |
– |
– + |
|
|
|
Zn |
Рис. 8.6. Схема медно-цинкового гальванического элемента. |
|||||
+ |
– |
– |
+ |
+ – |
– + |
|
|
+ |
– |
– |
+ |
||
|
○ |
- внутренняя цепь, □ – внешняя цепь |
||||
А |
+ |
– |
– |
+ |
|
|
+ – |
– + |
+ – |
– + |
|||
|
+ – |
– + |
||||
|
ZnSO4 |
→ Zn 2+ + SO4−2 |
CuSO4 → Cu 2+ + SO4−2 |
|||
А
Cu
К
Способность растворяться у цинка больше, чем у меди, поэтому и концентрация избыточных электронов на цинковом электроде будет больше, чем на медном.
155
Поскольку потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди (т.е. от-
туда, где их больше, туда, где их меньше).
Этот переход электронов нарушит равновесия (8.6) и (8.7) и новые ионы цинка перейдут в раствор, а на медном электроде будут восстанавливаться катионы меди из раствора (т.е. Zn будет растворяться, а на медном электроде будет восстанавливаться медь):
ìZn0 - 2e ® Zn2+ - окислительный процесс |
(8.8) |
|
íCu2+ + 2e ® Cu0 - восcтановительный процесс |
(8.9) |
|
î |
|
|
Суммарно: |
Zn0 + Cu2+ → Zn2+ + Cu0 (токообразующая реакция) |
|
Или: |
Zn + CuSO4 → ZnSO4 + Cu |
|
Одно из отличий химического процесса от электрохимического:
–при действии Zn на раствор CuSO4 электроны непосредственно переходят от атомов Zn к ионам Cu – химический процесс.
–при работе гальванического элемента электроны от Zn к Cu2+ со-
вершают путь по внешнему проводнику – электрохимический процесс.
Однако процесс быстро прекратится из-за наступившей концентрационной поляризации: в растворе ZnSO4 будут накапливаться ио-
ны Zn2+ , а в растворе CuSO4 – анионы SO42− , что воспрепятствует дальнейшему протеканию процесса. Во избежание этого оба раствора соединяют трубкой, заполненной раствором электролита (или пористой перегородкой), что делает возможным диффузию избыточных
анионов SO42− и катионов Zn2+ из одного сосуда в другой. Это при-
водит к устранению концентрационной поляризации. Теперь гальва-
нический элемент будет работать до тех пор, пока не выравняются потенциалы электродов или не растворится весь Zn (или не высадится вся медь на медном электроде).
Различают внутреннюю и внешнюю цепь гальванического элемента.
Внутренняя цепь – это участки электродов, погружённые в растворы электролитов, и сами растворы, являющиеся проводниками второго рода.
Внешняя цепь – всё остальное.
Мы рассматриваем только внутреннюю цепь. Для этой цепи:
156
Анод (-А) – это электрод, на котором протекает процесс окисления. Он отдаёт электроны во внешнюю цепь. Это более активный металл (для внешней цепи он катод).
Катод (+К) – это электрод, на котором протекает процесс восстановления. Он принимает электроны, идущие по внешней цепи. Это менее активный металл (для внешней цепи он анод).
Схематически гальванический элемент изображают так:
|
|
|
|
ē |
|
|
|
|
|
|
|
ē |
||||||
(−)Zn |
|
ZnSO |
|
|
|
CuSO |
|
Cu(+) |
или: |
(−)Zn |
|
Zn2+ |
|
|
|
Cu2+ |
|
Cu(+) |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|||||||||||||||
|
|
4 |
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где: | – граница раздела электрод – раствор.
|| – соединительная трубка (или пористая перегородка). Чтобы получить гальванический элемент, металлы – электроды
не обязательно погружать в растворы их же солей. Так, в элементе Вольта цинковый и медный электроды погружены в раствор H2SO4. Его схема:
ē
(−)Zn H2SO4 Cu(+)
(−)A: Zn0 − 2e− = Zn2+
(+)K : 2H + + 2e− = H2 −
Таким образом, элемент Вольта даёт электрический ток за счёт взаимодействия цинка с кислотой:
Zn + H2 SO4 = ZnSO4 + H2 −.
В технике направление электрического тока принято противоположным потоку электронов. Исторически это обусловлено существовавшим до открытия электронов, как носителей отрицательного заряда, представлением о протекании по проводнику положительного электричества.
Итак, причиной возникновения электрического тока в гальваническом элементе, т.е. причиной передвижения электронов во внешней цепи, является разность потенциалов.
ЭДС гальванического элемента. Электродвижущая сила (ЭДС)
– это разность потенциалов гальванического элемента, если сила тока в нём равна нулю.
157

ЭДС гальванического элемента всегда имеет положительное значение. Её определяют, вычитая из потенциала катода потенциал анода.
ЭДС = Eкатода − Еанода |
(8.10) |
Например, ЭДС элемента Даниэля–Якоби (когда электроды погружены в одномолярные растворы) будет равно:
ЭДС = ЕCu0 / Cu2+ − EZn0 / Zn2+
ЭДС = 0,34 − (−0,76) =1,1В
Если электроды погружены в растворы своих солей, концентрации которых отличаются от одномолярных, то перед вычислением ЭДС этого гальванического элемента необходимо с помощью уравнения Нернста определить электродные потенциалы обоих металлов и затем из потенциала катода (т.е. менее активного металла) вычислить потенциал анода (т.е. более активного металла).
Пример: Определить ЭДС гальванического элемента, составленного из цинка, погруженного в 0,01М раствор ZnSO4 и серебра, погруженного в 0,001М раствор AgNO3.
1.Определяем потенциалы цинка и серебра:
EZn / Zn2+ = −0,76 + 0,0592 lg10−2 = −0,819B.
EAg / Ag + = 0,80 + 0,0591 lg10−3 = 0,623B.
2.Определяем ЭДС гальванического элемента:
ЭДС = EAg / Ag + − EZn / Zn2+ = 0,623 − (−0,819) = 1,442В.
8.5.2. Концентрационные гальванические элементы
ЭДС возникает и при электродах из одного и того же металла, погружённых в растворы одной и той же соли, но различной концен-
трации (рис. 8.7).
В таком элементе электроны переходят по внешней цепи от электрода, погружённого в раствор с меньшей концентрацией, к электроду, погружённому в более концентрированный раствор . Это происходит потому, что электрод в менее концентрированном рас-
творе имеет более отрицательный потенциал (ранее мы уже упоми-
158
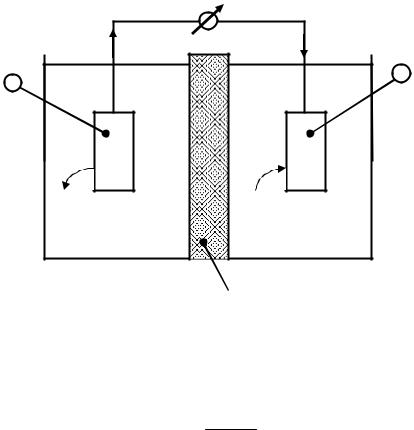
нали, что чем больше концентрация раствора, тем меньше отрицательный заряд электрода и наоборот). Значит, левый электрод
(–)Анод, а правый (+) Катод.
А |
e |
e |
К |
|
|
+ |
|
– |
|
|
|
|
|
|
Zn |
Zn |
Zn2+ |
2+ |
|
Zn |
0,01М ZnSO4 |
1М ZnSO4 |
Пористая перегородка
Рис. 8.7. Концентрационный гальванический элемент.
ЭДС этих гальванических элементов небольшая:
EZn / Zn2+ (1M ) = −0,76B
EZn / Zn2+ (0,01M ) = −0,76 + 0,0592 lg10−2 = −0,819B ЭДС = −0,76 − (−0,819) = 0,059В.
ГЛАВА 9. ЭЛЕКТРОЛИЗ
Окислительно-восстановительные реакции, протекающие на электродах при прохождении постоянного электрического тока через раствор или расплав электролита, называются электролизом.
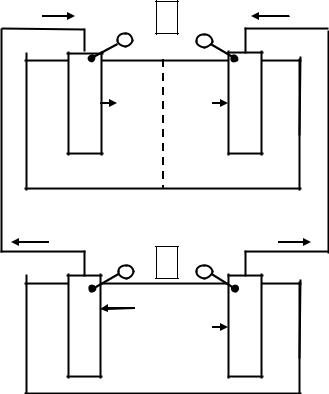
Сравнительная схема гальванического элемента и электролизёра представлена на рис. 9.1.
Принципиальное различие в действии гальванического элемента и электролизной ячейки (электролизёра) заключается в том, что процессы, протекающие в них, имеют противоположные направления. В
замкнутой гальванической цепи электрохимические процессы окисления и восстановления протекают самопроизвольно.
159
ē |
A |
а |
ē |
|
K |
|
|
|
– |
+ |
|
Zn |
Zn2+ |
Cu2+ |
Cu |
раствор ZnСl2 |
раствор CuСl2 |
||
|
(-) А: Zn0 - 2ē= Zn2+ |
|
|||
ē |
(+) К: Сu2+ + 2ē= Cu0 |
ē |
|||
К |
б |
А |
|||
|
|
||||
|
|
|
|||
|
– |
+ |
|
||
|
|
|
|||
|
|
Cu2+ |
Cl- |
|
|
|
|
|
|
||
|
раствор СuСl2 |
|
|||
(-) К: Сu2+ + 2ē= Cu0
(+) А: 2Cl- - 2ē= Cl2+
Рис. 9.1. Сравнительная схема, иллюстрирующая принцип действия гальванического элемента (а) и электролизной ячейки (б).
В электролизёре же электрохимические процессы окисления и восстановления идут под внешним воздействием электрического тока, т.е. самопроизвольно эти процессы не протекают.
Следует обратить внимание на то, что в гальваническом элементе отрицательный электрод (–) Анод, а положительный электрод
(+) Катод. В электролизёре, наоборот, отрицательный электрод
(–)Катод, а положительный электрод (+) Анод.
И в гальваническом элементе, и в электролизёре на аноде протекает процесс окисления, а на катоде – процесс восстановления.
Простейшим примером электролиза является электролиз расплавов. Рассмотрим процесс электролиза расплава NaCl (рис. 9.2).
При включении источника постоянного тока его можно рассматривать как «насос», который «выкачивает» электроны с (+) Анода и «перекачивает» их на (–) Катод.
Появление в результате этого недостатка электронов на
(+)Аноде и их избытка на (–) Катоде вызывает направленное движение ионов в электролите (расплаве NaCl).
160
