
химия + методичка / theory
.pdfОбеззараживание воды проводят для удаления из нее болезнетворных микроорганизмов и вирусов, присутствие которых делает воду непригодной для хозяйственно – питьевых нужд. Присутствие некоторых микроорганизмов и бактерий (например, железобактерий) вызывает биологическое обрастание, а иногда и разрушение трубопроводов и оборудования.
Для обеззараживания применяют хлорирование воды, используя для этих целей газообразный Cl2, гипохлориты – NaClO, Ca(ClO)2 и ClO2. Для обеззараживания воды применяют также озон и УФ – облучение.
Умягчение воды – это снижение её жесткости. (См. раздел «Жёсткость воды»).
Опреснение и обессоливание. Удаление солей из воды до предела, близкого к содержанию их в дистиллированной воде (доли или несколько мг/л) называется обессоливанием, а удаление солей до концентраций, допустимых при применении воды для питья (до 1 г/л),
называется опреснением.
Обезжелезивание применяют для снижения содержания в подземных водах железа, которое обычно находится в виде Fe(HCO3)2, а в поверхностных водах – в виде тонкодисперсной взвеси гидроксида или входит в состав комплексных органических веществ.
Обескремнивание применяют для снижения содержания H2SiO3 и её солей в природных водах, в которых содержится от 1 до 50…60 мг/л H2SiO3 и ее солей. Эти вещества в больших концентрациях недопустимы в воде, используемой для питания паровых котлов (образуется накипь), а также при производстве целлюлозы, полупроводников, лекарственных препаратов.
Растворенные в воде газы (O2, CO2, H2S) повышают ее коррозионную активность и придают неприятный вкус и запах (H2S, CH4). Поэтому часто воду подвергают дегазации. На тепловых электростанциях дегазация – один из важных процессов, осуществляется главным образом пропусканием через воду пара.
17.2. Жёсткость воды
Как отмечалось выше, вода широко используется во всех сферах человеческой деятельности. С развитием техники расход воды быстро растет, и проблема воды для технических целей и бытовых нужд во многих странах мира остается нерешенной.
Существенное влияние на свойства воды оказывают растворенные в ней примеси. Так, вода морей и океанов непригодна для полива,
271

питья и очень многих технических целей, т.к. в ней содержится большое количество солей. Пресная речная и артезианская вода также содержит различные примеси, но в значительно меньших количествах. Эти примеси необходимы для человека, животных и растений, но часто оказываются очень вредными при использовании такой воды в технике. Так, примеси солей кальция и магния в паровых котлах образуют плотный осадок на стенках котла и трубопроводах (накипь), что часто приводит к нежелательным местным перегревам, забиванию труб и т.д.
Жесткость воды – это мера содержания в воде солей двухвалентных металлов, прежде всего кальция и магния.
Так, в природных условиях образование гидрокарбонатов происходит при взаимодействии угольной кислоты с известняком (а) и доломитом (б):
Различают временную (устранимую), или карбонатную жест-
кость и постоянную (некарбонатную) жесткость.
Карбонатная жесткость (ЖК) обусловлена содержанием в воде гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. При кипячении воды эти гидрокарбонаты разлагаются с образованием труднорастворимых карбонатов, выпадающих в осадок, вследствие чего жесткость – уменьшается. Поэтому карбонатная жесткость называет-
ся временной.
Некарбонатная жесткость (ЖН), обусловленная содержанием в воде хлоридов и сульфатов кальция и магния (CaCl2, MgCl2, CaSO4, MgSO4), кипячением воды не устраняется и поэтому называется по-
стоянной.
Общая жесткость (ЖОБЩ) представляет собой сумму карбонатной и некарбонатной жесткости:
272

Жесткость воды количественно выражается числом миллимолей эквивалентов ионов кальция Са2+ и магния Mg2+, содержащихся в 1л воды.
1 ммоль экв/л жесткости воды соответствует содержанию 20,04 мг/л ионов Са2+ или 12,16 мг/л ионов Mg2+.
Общая жесткость рассчитывается по формуле

























 , (17.1)
, (17.1)
где:[Ca2+] и [Mg2+] – концентрации ионов Ca2+ и Mg2+, в мг/л.
Таблица 17.2
Характеристика воды по степени жесткости
Характеристика воды по жесткости. |
Жобщ, ммоль экв/л. |
|
Очень мягкая вода |
Не более 1,5 |
|
|
|
|
Мягкая вода |
От 1,5 |
до 4,0 |
|
|
|
Вода средней жесткости |
От 4,0 |
до 8,0 |
|
|
|
Жесткая вода |
От 8,0 |
до 12,0 |
|
|
|
Очень жесткая вода |
Свыше 12,0 |
|
|
|
|
Жесткость природной воды зависит от источника и времени года. Во время весенних паводков жесткость воды поверхностных бассейнов уменьшается, а в зимний период возрастает. Например, морская вода имеет общую жесткость 65 ммоль экв/л.
В жесткой воде плохо мылится мыло, которое представляет собой натриевые соли высших карбоновых кислот, например, стеарат натрия C17H35COONa. При растворении мыла в жесткой воде образуются плохо растворимые в воде стеараты кальция и магния:



















































 ;
;
Это происходит до тех пор, пока из раствора не будут удалены все ионы кальция и магния. Поэтому применение жесткой воды в коммунальном хозяйстве и быту вызывает непроизводительную трату мыла.
Для устранения жесткости воды (её умягчения) необходимо ионы Ca2+и Mg2+ перевести в осадок.
273

Временную (карбонатную) жесткость воды устраняют кипячением, т.к. при этом гидрокарбонаты кальция и магния разлагаются, образуя нерастворимые карбонат кальция и гидроксид магния:












































 ;
;


















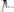







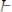
















 .
.
Однако применение этого метода, как отмечалось выше, приводит к образованию накипи в нагревательных приборах.
Постоянную жесткость кипячением устранить нельзя.
Для устранения общей жесткости воды в нее добавляют, например, смесь гашёной извести Са(ОН)2 и соды Na2CO3 (известковосодовый способ). При этом временная жёсткость воды устраняется гашёной известью:























































 ;
;

























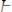



































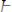




 ,
,
А постоянная – содой:











































 ;
;
















































 .
.
Современные способы умягчения воды основаны на применении катионитов (катионитный способ).
Катионитами называются твердые вещества, содержащие в своем составе подвижные катионы, способные обмениваться на ионы внешней среды. Для устранения жесткости воды в качестве катиони-
тов применяют алюмосиликаты, например Na2[Al2Si2O8·n H2O]. Это
соединение можно условно выразить формулой Na2R, где R – это анион.
При пропускании жёсткой воды через колонку (рис. 17.3), заполненную катионитом, происходит обмен катионов:




























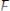
 ;
;






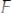


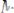





















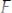
 .
.
274
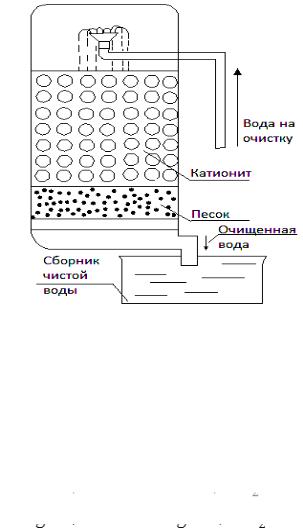
На катионите задерживаются катионы Ca2+и Mg2+, а в раствор переходят ионы Na+; в результате этого процесса жесткость воды уменьшается.
Рис 17.3. Ионообменный фильтр
Через некоторое время, когда большая часть ионов Na+ катионита обменяется на катионы Ca2+и Mg2+, катионит необходимо регенерировать, т.е. восстановить его первоначальные свойства. Для этого через катионообменные колонки пропускают насыщенный раствор хлорида натрия NaCl, при этом происходят обратные процессы:



























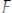
 ;
;
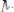



















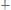







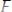
 .
.
После промывки катионит можно снова использовать для умягчения воды.
Пример: Вычислить жесткость воды, если известно, что в 100 л
еесодержится 40,5г Ca(HCO3)2.
1вариант решения: В 1 литре воды содержится
40,5/100=0,405г=405мг Ca(HCO3)2, что составляет:
405/81=5 ммоль·эквивалентов (81г/моль – эквивалентная масса Ca(HCO3)2). Следовательно, жесткость воды равна 5 ммоль экв/л.
2вариант решения: Эту задачу можно решить, применяя фор-
мулу:
Ж = |
m |
, |
(17.2) |
|
mэ ×V |
||||
|
|
|
||
275 |
|
|
||

где: Ж – жесткость воды, ммоль экв/л; m – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости воды, мг; mЭ – эквивалентная масса этого вещества, мг/моль; V – объем воды, л.
17.3. Водород. Свойства, получение, применение в технике
Водород – первый, наиболее легкий химический элемент периодической системы элементов Д.И.Менделеева. Латинское название водорода – гидрогениум (Hydrogenium), что означает «рождающий воду».
Атом водорода имеет один электрон, занимающий 1s1 орбиталь; степень окисления обычно +1 и только в гидридах щелочных метал- лов–1. Энергия ионизации H0→H++ē равна 13,595 эВ; сродство к электрону 0,75 эВ; электроотрицательность по Полингу 2,1; атомный радиус 0,053 нм.
Вприроде водород существует в виде трех изотопов с массовыми числами 1,2,3. Легкий нуклид водорода 

 –протий, его ядро состоит из протона и не содержит нейтронов; тяжелый водород
–протий, его ядро состоит из протона и не содержит нейтронов; тяжелый водород 
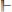
 – дейтерий (Д) – ядро состоит из протона и нейтрона; сверхтяжелый водород
– дейтерий (Д) – ядро состоит из протона и нейтрона; сверхтяжелый водород 


 –тритий (Т) – ядро, кроме протона, содержит 2 нейтрона. Протий и дейтерий являются стабильными изотопами, а тритий – радиоактивный (период полураспада 12,26 года).
–тритий (Т) – ядро, кроме протона, содержит 2 нейтрона. Протий и дейтерий являются стабильными изотопами, а тритий – радиоактивный (период полураспада 12,26 года).
Вприродном водороде преобладает протий. Соотношение изо-
топов в природном водороде следующее: Н:Д:Т=1:1,46·10-5:4,00·10-15.
Это означает, что, например, на 1 атом дейтерия в природном водороде приходится примерно 6800 атомов протия. Содержание трития на Земле постоянно и составляет примерно 2,8 кг.
Изотопы водорода образуют шесть видов молекул водорода: Н2,
НД, НТ, Д2, ДТ и Т2.
В периодической системе элемент водород обычно помещают одновременно и в IА группу (группу щелочных Ме) и в VIIА группу (группу галогенов). Это объясняется наличием у водорода свойств,
276
роднящих его как со щелочными металлами, так и с галогенами. Подобно первым представителям галогенов (фтору и хлору) простое вещество водород при стандартных условиях находится в газообразном агрегатном состоянии, и молекула водорода так же двухатомна. Как и галогены, водород в твердом состоянии не проводит электрический ток (диэлектрик).
В то же время для водорода, как и для щелочных металлов, характерны восстановительные свойства. Наконец, для водорода, подобно щелочным металлом и металлом вообще, характерна высокая теплопроводность.
Впервые получил водород и изучил его свойства Г.Кавендиш (1766 г). Идентифицировал водород как элемент А. Лавуазье (1784 г).
Нахождение в природе. Свободного (молекулярного) водорода в
атмосфере Земли очень мало (объемная доля 5·10-5%); как легкий газ
он находится в основном в верхних слоях атмосферы. Небольшие количества свободного водорода содержатся в вулканических и природных газах.
На Земле водород находится в связанном состоянии, т.е. в виде соединений с О, С, S, N, Cl, P, I, Br и др. элементами; он входит в состав всех растительных и животных организмов, нефти, ископаемых углей, природного газа, воды, ряда минералов и пород (в виде гидра-
тов). Водород – самый распространенный элемент Вселенной: в виде плазмы он составляет около половины массы Солнца и большинства звезд, входит в состав Юпитера, Сатурна и Урана, является основной частью газа межзвездной среды и газовых туманностей.
Физические свойства водорода. При обычных условиях водород
– газ без цвета, запаха и вкуса. Плотность его составляет примерно 0,09 г/дм3 – это самое легкое вещество на Земле. Легкие молекулы водорода двигаются с огромной скоростью (примерно 1800 м/с), поэтому теплопроводность водорода очень высока – в 7 раз больше, чем у воздуха. Это означает, что нагретый брусок металла в атмосфере водорода остывает в 7 раз быстрее, чем на воздухе. Водород очень трудно сжижается (tКИП = –252,72 °С), уступая в этом отношении только гелию. Жидкий водород выглядит как вода, но плотность его настолько мала, что корковая пробка в нем тонет. В воде водород рас-
277

творяется плохо (2 объема в 100 объемах Н2О при обычных условиях). Водород очень хорошо поглощается некоторыми металлами (Ni, Pt, Pd). Например, 1 объем Pd может растворить до 900 объемов водорода. При нагревании насыщенного водородом Pd водород легко выделяется обратно.
Молекулы водорода, благодаря своей малой массе и размерам, обладают высокой скоростью диффузии и способны легко проникать через стенки сосуда, в котором он содержится. При температуре порядка 300–600 °С водород способен диффундировать сквозь стенки металлического или стеклянного сосуда, в котором он заключен. Это свойство используется для получения водорода очень высокой чистоты.
Химические свойства водорода.
Водород непосредственно не реагирует с P, Si, B, благородными газами и некоторыми металлами. При обычных условиях, а также в темноте и при температуре –250°С с сильным экзотермическим эффектом водород реагирует только с активным галогеном – фтором:
При освещении или нагревании водород реагирует с хлором:
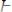















 .
.
С бромом и йодом водород реагирует при нагревании до 400– 500 °С обратимо:
















 ;
;











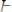

 .
.
При нагревании (в присутствии Pt как катализатора даже при комнатной температуре) водород взаимодействует с кислородом воздуха:
























 ;
;





















 .
.
Смесь Н2 и О2 в отношение 2:1 по объему называется гремучим газом и очень взрывоопасна.
С серой водород реагирует обратимо при нагревании:
278
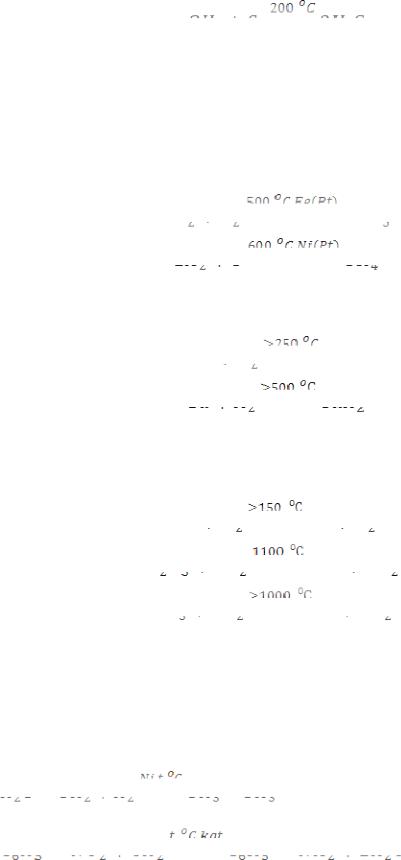

















 .
.
Выше 200 °С равновесие процесса смещается в сторону распада сероводорода, т.е. влево, ниже – в сторону его образования (вправо), однако при t <200 °С скорость образования сероводорода чрезвычайно мала.
Также обратимы при нагревании реакции H2 c N2 и C, скорость которых возрастает при использовании катализатора:


































 ;
;









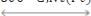




 .
.
При нагревании водород реагирует со щелочными и щелочноземельными металлами с образованием гидридов:





















 ;
;




















 .
.
Водород – дешевый и доступный восстановитель, поэтому широко используется для получения металлов посредством их восстановления из оксидов:

























 ;
;
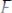


















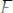











 ;
;
































 .
.
Однако водород нельзя использовать для получения из оксидов тех металлов, сродство которых к кислороду выше, чем для водорода. К таким металлам относятся Be, Al, Mg, а также щелочные и щелочноземельные металлы.
Водород выступает в роли восстановителя и в реакциях с органическими веществами:


































 (гидрирование двойной связи);
(гидрирование двойной связи);
этилен этан



















































 (восстановление нитробензола до анилина).
(восстановление нитробензола до анилина).
279

Для промышленных способов получения водорода в качестве сырья используются вода и попутные или природные газы.
Основные промышленные способы получения водорода следую-
щие:
1) Взаимодействие водяных паров с раскаленным углем: 





























 («водяной газ»).
(«водяной газ»).
2)Конверсия (превращение) метана в присутствии катализаторов (Ni или Al2O3):
3)Железопаровой способ:
4)Электролиз воды, в которую для повышения электрической проводимости добавляют электролиты KCl или NaCl:






















 .
.
5)Электролиз водного раствора NaCl:
6)Крекинг (пиролиз) метана:
Большие количества водорода (точнее, азотоводородной смеси для синтеза аммиака) в промышленности получают глубоким охлаждением (до –190 °С) коксового газа, который содержит до 60% Н2 по
280
