
химия + методичка / theory
.pdfКак видим, в системе нет избыточных Н+ и ОН- по сравнению с их содержанием в воде. Кроме того, никаких других слабодиссоциирующих или труднорастворимых соединений не образуется. Значит, никакого разлагающего действия на NaCl вода не оказала.
Следовательно, соли, образованные сильными кислотами и сильными основаниями, гидролизу не подвергаются, т.к. катионы сильных оснований и анионы сильных кислот не могут связывать ионы воды, поэтому реакция растворов этих солей остаётся практиче-
ски нейтральной (рН=7).
2. Соль слабой кислоты и сильного
основания.СН3СООNa+H2O CH3COOH+NaOH
CH3COO-+Na++H2O CH3COOH+Na++OH-
или: CH3COO-+H2O CH3COOH+OH-
Уравнение показывает, что гидролизу подвергается анион соли и что реакция сопровождается высвобождением ионов OH-. Но поскольку ионное произведение воды [Н+]∙[OH-] – величина постоян-
ная, то накопление ионов ОН- приводит к уменьшению концентрации ионов Н+, т.е. [ОН-]>[ Н+]
Значит, растворы солей, образованных слабой кислотой и силь-
ным основанием, имеют щелочную реакцию (рН>7).
3. Соль сильной кислоты и слабого основания. Здесь гидролизу подвергается катион соли и реакция сопровождается высвобождением
водородных ионов Н+:
141
NH4Cl+H2O NH4OH+HCl
NH4++Cl-+H2O NH4OH+H++Cl-
NH4++H2O NH4OH+H+
Накопление ионов Н+ приводит к уменьшению концентрации ионов ОН-, т.е. [Н+]>[OH-]
Значит, растворы солей, образованных сильной кислотой и сла-
бым основанием, имеют кислую реакцию (рН<7).
4. Соль слабой кислоты и слабого основания. Соли этого типа подвергаются гидролизу сравнительно легко:
CH3COOH4+H2O CH3COOH+NH4OH
CH3COO-+NH4++H2O CH3COOH+NH4OH
Здесь реакция и “рН” среды зависят от относительной силы образующихся основания и кислоты.
Если Кд кислоты >Кд основания, то раствор имеет слабокислую реакцию. Если Кд кислоты <Кд основания, то реакция слабощелочная.
142

5. Полный гидролиз солей. Полному гидролизу солей подвергаются соли слабого основания и слабой кислоты, если образовавшая их
кислота непрочна (как H CO3) или летуча (H S):














































 - оба образующиеся вещества выводятся из сферы реакции.
- оба образующиеся вещества выводятся из сферы реакции.
Степень гидролиза (h).
В случаях, когда гидролизу подвергается не всё количество соли, а только часть его, в растворе устанавливается равновесие между солью и образующими ее кислотой и основанием.
Равновесное состояние системы при гидролизе характеризуется степенью гидролиза (h), которая показывает, какая часть от общего числа молей растворенной соли подверглась гидролизу.







 .
.
Степень гидролиза зависит:
1.От химической природы соли:
Чем слабее кислота и основание, ее образующие, тем полнее сдвинуто равновесие гидролиза вправо, и следовательно, тем больше степень гидролиза.
2.От температуры:
При повышении температуры усиливается диссоциация воды (см. выше), т.е. увеличивается концентрация ионов H+ и OH−, значит, увеличивается ионное произведение воды. Поэтому с повышением температуры степень гидролиза возрастает.
3. От концентрации раствора соли:
При уменьшении концентрации, т.е. разбавлении раствора, степень гидролиза увеличивается.
Практический вывод: Для усиления гидролиза нужно работать с разбавленными растворами при повышенной температуре.
7.13. Кислоты, основания, соли
Важнейшими классами химических веществ являются кислоты, основания и соли.
143

Рассмотрим понятия «кислота» и «основание» с точки зрения теории электролитической диссоциации Аррениуса (существуют также теории кислот и оснований Д.Бренстеда , Д.Льюиса и др.)
Кислотами называются электролиты, диссоциирующие в водных растворах с образованием ионов водорода [Н+] и не дающие никаких других положительно заряженных ионов.
При диссоциации кислоты наряду с катионами Н+ образуются анионы кислотного остатка.
Наличие в водных растворах кислот общих свойств (кислый вкус, изменение окраски индикатора) обусловлены наличием ионов Н+.
Кислота тем сильнее, чем больше в растворе концентрация ио-
нов водорода Н+. Классификация кислот. а. По основности
Основность кислоты – это число атомов водорода, которые в молекуле кислоты могут замещаться атомами металла. По основности кислоты делятся на:
–одноосновные, молекулы которых содержат один атом водо-
рода ( HCl, HNO3, HCN и др.).
–многоосновные: H2S, H2SO4 и др. – двухосновные; H3PO4, H3BO3 и др. – трёхосновные;
б. По содержанию атомов кислорода
–бескислородные (HCl, HCN, H2S и др.)
–кислородсодержащие (оксокислоты) - HNO3, H2SO4 и др. Многоосновные слабые кислоты диссоциируют ступенчато,
причем константа диссоциации по I стадии всегда больше, т.к. при отщеплении протонов Н+ на последующих стадиях надо преодолевать притяжение со стороны отрицательного иона остатка кислоты.
Например, диссоциация фосфорной кислоты:
1 ступень:












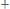





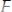





















 ;
;
2 ступень: |
; |
3 ступень: |
; |
144

Ступенчатая диссоциация многоосновных кислот обусловлива-
ет образование кислых солей (например KH PO4, K HPO4 и др. гид-
росолей).
Основания – это электролиты, диссоциирующие в водных растворах с отщеплением ионов гидроксида ОН− и не дающие никаких других отрицательно заряженных ионов:
Чем больше концентрация ионов ОН− в растворе, тем сильнее основание.
Основания делятся:
а) По числу гидроксидных групп – на:
– однокислотные ( NaOH, KOH);
– многокислотные: Ca(OH)2, Ba(OH)2 – двухкислотные; Ni(OH)3,Fe(OH)3 – трёхкислотные;
б) По растворимости в воде – на:
–растворимые (сильные) - щелочи ( NaOH, KOH и др.);
–нерастворимые (слабые) - Cu(OH)2,Fe(OH)3 и др. Многокислотные основания также диссоциируют ступенчато:


































 (1 ступень);
(1 ступень);













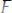


















 (2 ступень);
(2 ступень);
(3 ступень);













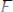













 .
.
Ступенчатая диссоциация многокислотных оснований обуслов-
ливает образование основных солей: Fe(OH) Cl, Fe(OH)Cl и др. гид-
роксосолей.
145
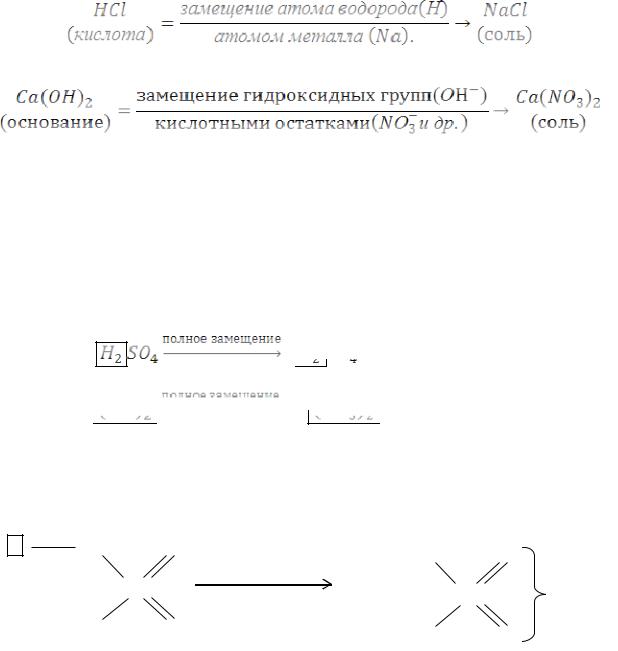
Соли – это продукты замещения атомов водорода в молекулах кислот атомами металла или это продукты замещения гидроксидных групп в молекулах оснований кислотными остатками.
Состав нормальных солей выражается общей формулой: MeX(Aс)Y, где: Aс– кислотный остаток; x – число атомов метал-
ла; y – число кислотных остатков (например, K3PO4, MgSO4, Al2(SO4)3 и др.)
Т.е. нормальные (средние) соли - это продукты полного замещения атомов водорода в молекуле кислоты атомами металла или продукты полного замещения OH-групп в молекулах оснований кислотными остатками:









 – сульфат калия.
– сульфат калия.









































 – нитрат железа.
– нитрат железа.
Кислые соли (гидросоли) – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла:
Н |
|
O |
O |
|
|
|
|
|
|
|
неполное замещение |
Na |
|
O |
O |
|
|||
|
|
|
S |
|
|
||||
|
|
|
|
|
|||||
|
|
|
|
|
|
S |
|
NaHSO4 |
|
|
|
|
|
|
|
|
|
||
H |
|
O |
O |
|
H |
|
O |
O |
кислая |
|
|
|
соль |
||||||
|
|
|
|
|
|
Основные соли (гидроксосоли) – это продукты неполного замещения OH-групп в молекулах многокислотных оснований кислотными остатками
146
Fe(OH)2 Fe(OH)Cl
(Fe(OH)Cl – основная соль – гидроксохлорид железа)
ГЛАВА 8. ОСНОВЫ ЭЛЕКТРОХИМИИ
Химические процессы, сопровождающиеся появлением электрического тока или процессы, вызываемые подведённой извне электрической энергией, называются электрохимическими.
Получение электрической энергии за счёт химических реакций происходит в гальванических элементах.
Возникновение химических реакций за счёт затраты электрической энергии происходит при электролизе.
Основное отличие химических процессов от электрохимических:
∙в химических процессах химическая энергия превращается в тепловую энергию;
∙в электрохимических процессах химическая энергия превращается в электрическую энергию или электрическая в химическую.
8.1. Электродные потенциалы. Механизм возникновения
Как отмечалось ранее, кристалл любого металла можно представить как равновесную систему, состоящую из атомов, катионов и электронов.
Если какой-либо металл привести в контакт с водой, то полярные молекулы воды вступят во взаимодействие с катионами поверхностного слоя (рис. 8.1).
Врезультате катионы Men+ будут отторгнуты от кристаллической решётки металла и перейдут в раствор, где в непосредственной близости от его поверхности создают положительный электрический заряд (раствор заряжается положительно).
Вмассе металла при этом будут оставаться электроны, которые создают в пограничном с жидкостью слое металла отрицательный электрический заряд (металл заряжается отрицательно).
147

металл
Рис. 8.1. Взаимодействие катионов металла с молекулами воды.
В результате на границе металл – вода образуется двойной электрический слой, а следовательно возникает разность потенциалов, ко-
торую называют электродным потенциалом металла EMe / Men+
(рис.8.2).
адсорбционный
слой
Me
диффузионный
слой
e 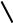 Me n+
Me n+
Рис. 8.2. Образование двойного электрического слоя.
По мере перехода катионов в водную среду увеличивается отрицательный заряд металла и положительный заряд раствора, поэтому всё чаще и чаще ионы металла (Me n+) притягиваются обратно на металлическую пластинку. Быстро наступающее равновесие можно изобразить следующей схемой:
(Men+ × ne) + m × H O « Men+ × mH |
O + |
ne |
(8.1) |
|
2 |
2 |
|
в металле |
|
|
в растворе |
|
||
148
где n – число валентных электронов; ( Men+ × ne ) – атом метал-
ла в кристаллической решётке; ( Men+ × mH2O )
ион металла в растворе.
Или, без учёта гидратации ионов:
Me0 ↔ Men+ + ne
раствор металл
– гидратированный
(8.2)
Концентрация ионов металла [ Men+ ] в растворе при равновесии очень мала.
Увеличим концентрацию ионов металла в растворе, добавив в него, скажем, растворимую соль этого металла, например:
Zn0 ↔ Zn2+ + 2e
+
ZnSO4 ® Zn2+ + SO42−
В этом случае в соответствии с принципом Ле Шателье равновесие (8.2) будет смещено влево, что приведёт к уменьшению избытка электронов на металле, т.к. эти дополнительные катионы будут связываться с электронами на металле и восстанавливаться. В результате количество электронов на металле уменьшится.
Таким образом, отрицательный заряд металлической пластинки тем меньше, чем больше концентрация ионов металла в растворе.
При значительном увеличении концентрации смещение равновесия (8.2) может привести к тому, что пластина – электрод приобретёт даже положительный заряд за счёт внедрения в кристаллическую решётку металла катионов растворённой соли. Окружающий раствор при этом заряжается теперь уже отрицательно за счёт избытка анионов соли и снова появляется двойной электрический слой, т.е. разность потенциалов. Такая ситуация характерна для так называемых малоактивных металлов (например Сu). Активные же металлы (например Zn) при любой концентрации раствора сохраняют способность посылать свои катионы в раствор, т.е. пластинка по-прежнему заряжается отрицательно (рис. 8.3).
149
Zn 2+
ZnSO → |
CuSO4 → |
4 |
|
Zn2+ + SO42 |
Cu 2+ + SO42− |
|
SO2− |
е Zn 2+ |
4 |
2− |
|
Cu 2+ |
SO4 |
Рис. 8.3. Образование двойного электрического слоя у активных (Zn) и малоактивных (Сu) металлов.
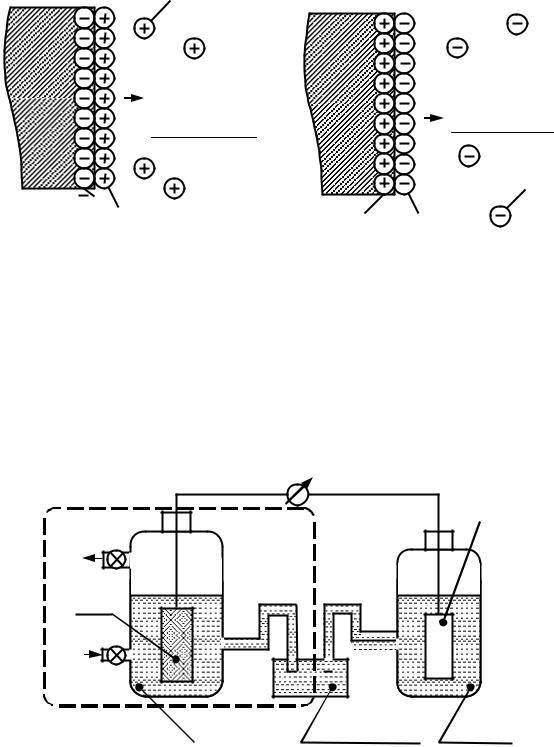
8.2. Устройство и назначение стандартного водородного электрода
Измерить абсолютные значения электродных потенциалов металлов не удаётся. Поэтому их измеряют, сравнивая с другим таким же электродным потенциалом, величину которого условно принимают за нуль. В качестве такого электрода – эталона принят стандартный водородный электрод (рис. 8.4).
Me
H2
Pt
H2
1M H2SO4 |
раствор KCl |
1M MeSO4 |
Рис. 8.4. Измерение стандартных электродных потенциалов металлов с помощью стандартного водородного электрода.
Водородный электрод представляет собой платиновую пластину, покрытую рыхлым слоем мелкораздробленной платины и опу-
150
