
химия + методичка / theory
.pdfКак кислотный оксид SiO2 при нагревании или сплавлении реагирует с основными оксидами, щелочами и некоторыми солями (например, карбонатами) с образованием солей кремниевой кислоты – силикатов.
SiO2 + Na2O = Na2SiO3;
SiO2 + 2NaOH = Na2SiO3 + H2O;
SiO2 + Na2CO3 = Na2SiO3 + CO2.
Концентрированные растворы полученных искусственным путем силикатов натрия и калия – жидкое стекло – применяют для изготовления несгораемых тканей, клеев, пропитки деревянных изделий и т.д. Частично обезвоженная кремниевая кислота Н2SiO3 (силикагель) используется для адсорбции влаги и других веществ.
Стекло. Сырьём для производства стекла являются сода Na2CO3, известняк CaCO3 и песок SiO2. Из этих компонентов получают обычное оконное стекло:
1400°С
6SiO2 + Na2CO3 + CaCO3 = Na2O·CaO·6SiO2 + 2CO2↑.
Окрашенные стёкла получают добавлением в шихту оксидов кобальта (синее стекло), оксида хрома (зеленое стекло), оксида титана (молочное стекло), хлорида серебра AgCl (солнцезащитное стекло, темнеющее тем сильнее, чем интенсивнее солнечное излучение).
Стекла особого назначения:
-кварцевое стекло – получают переплавкой диоксида кремния. Оно отличается высокой температурой размягчения и не трескается при резком охлаждении, т.к. обладает очень малым коэффициентом теплового расширения. Даже нагретое до температуры красного каления кварцевое изделия (тигель, трубка, чашка) не трескается при погружении в холодную воду.
-термостойкое стекло – благодаря наличию в нём около 12 %
оксида бора B2O 3 имеет очень малый коэффициент теплового расширения.
-оптическое стекло. Свинцовое оптическое стекло содержит около 49% монооксида свинца PbO, баритовое – около 42% монооксида бария BaO и 3% PbО.
-хрусталь – при сплавлении диоксида кремния SiO2 с поташом (К2CO3 ) и монооксидом PbO образуется стекло, обладающее большой лучепреломляющей способностью. Из хрусталя изготовляют оптические стёкла, художественные изделия и бытовую посуду.
261

- иенское стекло – в этом стекле оксид SiO2 частично заменен на B2O3 и Al2O3. Стекло очень термостойкое и применяется для изготовления химической и бытовой посуды.
Фарфор, фаянс, гончарные изделия. Для их производства приго-
товляют шихту из глинистых веществ, кварца и полевого шпата, с помощью воды переводят её в пластическое состояние, формируют изделия, высушивают их, обжигают при высокой температуре. Фарфор обжигают дважды: сначала при 900…1000 ºС, а затем при
1320…1350 ºС.
Цемент. Изготовляют обжигом смеси глины, известняка CaCO3
ипеска при 1400…1450 ºС во вращающихся трубчатых печах. Шихту составляют таким образом, чтобы в цементном клинкере (продукт после обжига) содержалось 64…67 % СаО, 21…24% SiO2, 4…7 % Аl2O3
и2…4 % Fe2O3. В результате обжига образуется алюминаты и силикаты кальция.
Цементный клинкер размельчают в специальных дробилках и мельницах. При смешивании цемента с водой происходит образование кристаллогидратов и цемент затвердевает. Изготовляют цемент
различных марок: 300, 400, 500, 600, 700 и 900. Марка цемента показывает нагрузку (кгс/см2), которую выдерживает без деформации затвердевший цемент через 28 дней после смешивания его с водой.
При смешивании цементного раствора с гравием, щебнем и мелким шлаком образуется масса, которую называют бетоном. Если этой массой залить железную арматуру, то образуется железобетон.
16.4. Германий
Германий (Ge) – твердое серебристо-серое вещество с металлическим блеском. Кристаллическая решетка – кубическая объемноцентрированная. Т.пл. = 950 ºС, Т.кип. = 2850 ºС, тверд и хрупок. Длительное время (открыт в 1885г.) германий не находил практического применения, теперь же является одним из основных полупроводников. (Его электропроводность сильно зависит от температуры и чистоты вещества).
Нахождение в природе и получение. Германий достаточно широко распространен, но в очень рассеянном виде, сопутствует полиметаллическим, медно-цинковым, железным рудам, встречается в природных углях (зольные летучие уносы). Общее содержание германия в земной коре – 2·10-4%. Наиболее известные, но очень редкие минералы, содержащие германий – германит Cu3(FeGe)S4, аргиродит Ag3GeS6 и некоторые другие.
262
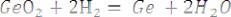
Получение: Германиевый концентрат разлагают соляной кислотой в присутствии окислителя, затем полученный GeCl4 гидролизуют, образовавшийся GeО2 высушивают и восстанавливают водородом при
650…700 ºС:
Полученный технический материал расплавляют при 1000 ºС и очищают зонной плавкой или выращиванием монокристаллов в вакууме.
Химические свойства. В соединениях германий проявляет степень окисления +4 и +2 (более типичными являются соединения, где Ge четырехвалентен).
На воздухе он не изменяется, вода на него также не действует. С кислородом взаимодействует только при температуре выше 700 ºС, образуя диоксид германия GeО2 :
Ge + О2=GeО2.
Германий не растворяется в разбавленной серной и соляной кислотах, медленно растворяется в щелочах в присутствии окислителей:
Ge + 2NaOH + 2H2O2 = Na2GeO3 + 3H2O.
При температуре 200…250ºС германий энергично взаимодействует с серой и галогенами:
Ge + 2S=GeS2; Ge + 2Cl2 == GeCl4.
Применение в технике. Германий применяют как полупроводниковый материал для диодов, транзисторов, термо- и фоторезисторов и др. Практически весь добываемый германий используют для этих целей. Германий должен быть очень высокой степени чистоты (99,9999999%), т.к. даже ничтожная примесь влияет на его электропроводность.
Используют Ge также как компонент сплавов, как материал для линз (в инфракрасных приборах и др.)
Важнейшие соединения. Диоксид германия GeO2. Это белый порошок, похожий на песок. Т.пл. = 1116 ºС. Растворим в воде, взаимодействует с соляной HCl и фтороводородной HF кислотами. Получают гидролизом GeCl4 или германатов щелочных металлов, окислением германия кислородом.
Применяют:
263
-для получения германия;
-компонент специальных стекол, стекловолокна и люминофоров. Дисульфид германия GeS2 – аморфное или кристаллическое ве-
щество, Т.пл. 825 ºС. Получают взаимодействием германия с серой при 1000-1100 ºС. Перспективный полупроводниковый материал.
Гидрид германия GeH4. Т.пл. = –165ºС, Т.кип. = –85 ºС. Растворим в воде и органических растворителях. Получают восстановлением хлоридов или оксидов германия водородом. Применяют в производстве полупроводниковых материалов.
Теллурид германия GeTe, Т.пл.= 725 ºС; не растворяется в воде, разлагается концентрированной HNO3, царской водкой. Получают из элементов – сплавлением в вакууме или реакцией в газовой фазе. Полупроводниковый материал для термоэлектрических генераторов.
ГЛАВА 17. ВОДА, ВОДОРОД 17.1. Природные воды, свойства воды, водоподготовка
Вода, оксид водорода H2O – важнейший из природных оксидов. Это самое распространенное на земном шаре вещество; вода покрывает около 3/4 земной поверхности, а ее общая масса составляет при-
мерно 1,4·1018т.
Подавляющая часть воды сосредоточена в морях и океанах и содержит много солей; это делает воду непригодной для питья, орошения и многих технических целей. На долю пресной воды приходится около 2,6% от ее общих запасов; в основном эта вода в виде льда сосредоточена на Северном и Южном полюсах и пока не доступна для человека. Доля же доступной пресной воды составляет всего 0,014% от общих запасов воды.
Вода входит в состав всех живых и растительных организмов. Например, человек на 70% состоит из воды, рыба – на 80%. Вода – основа жизни: если человек теряет в виде воды 12% массы тела, то наступает смерть; человек не может жить без потребления воды более 3–4 суток. Во всяком организме вода представляет собой среду, в которой протекают химические процессы, обеспечивающие жизнедеятельность организма. Кроме того, она участвует в ряде биохимических реакций.
264
Содержание пресной воды за последние десятилетия из-за хозяйственной деятельности человека сильно уменьшилось. Ежегодно в водные источники попадают тысячи тонн бытовых отходов, отходов промышленных предприятий, нефти и нефтепродуктов; огромную опасность для человека представляет загрязнение воды радиоактивными отходами атомных электростанций. В связи с этим большое значение имеет проблема охраны водных источников от истощения, а также защита их от загрязнений. Эта проблема решается созданием эффективных методов очистки воды, а также таких технологических процессов, в которых вода возвращается в процесс. Вода, очищенная перегонкой, называется дистиллированной.
Молекула воды имеет угловое строение в виде равнобедренного треугольника с длиной связи Н–О, равной 0,096 нм. Энергия связи Н–О в молекуле воды составляет 463 кДж/моль (рис. 17.1).
Рис. 17.1. Пространственное строение молекулы воды.
Электроны связи Н−О смещены к более электроотрицательному атому кислорода. Молекулы воды полярные. Полярность молекулы Н2О оказывает влияние её на химические и физические свойства.
При обычных условиях вода – жидкость без вкуса и запаха; в тонком слое она бесцветна, а при толщине 2м она приобретает голубоватый оттенок.
Вода проводит электрический ток. Электропроводность воды можно объяснить ее диссоциацией: 

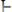





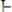



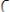



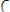



 или в упрощенном виде:
или в упрощенном виде: 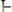









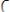



 .
.
|
|
|
Таблица 17.1 |
|
Некоторые физические свойства воды |
||
|
|
|
|
Свойство |
|
Величина |
Аномальность |
Плотность, г/см3 |
|
|
Как правило, вещество в твер- |
Жидкая (+4°С) |
|
1,00 |
дом состоянии имеет большую |
Лёд(−2°С) |
|
0,92 |
плотность, чем в жидком. |
TКИП, °С |
|
100 |
Слишком высокие для вещест- |
|
ва с такой сравнительно малой |
||
TПЛ, °С |
|
0 |
|
|
молярной массой. |
||
|
|
|
|
265
Диэлектрическая про- |
80,4 |
Одна из самых высоких среди |
|
ницаемость, ε |
известных веществ. |
||
|
|||
|
|
|
Аномальные свойства воды объясняются образованием между молекулами воды водородных связей. Каждая молекула Н2О может участвовать в образовании четырех водородных связей: две водородные связи образуются с участием 2х неподелённых электроннных пар атома кислорода (донорно-акцепторный механизм), а еще две − за счет положительно поляризованных атомов водорода (электростатический механизм) – см. рис.17.2.
Длина водородной связи −Н···О− между молекулами воды равна
0,177 нм, а ее энергия составляет примерно 21кДж/моль. Следова-
тельно, водородная связь −Н···О− длиннее и менее прочная, чем кова-
лентная σ-связь Н – О в молекуле Н2О.
Рис. 17.2. Образование водородных связей между молекулами воды.
С повышением температуры от 0°С происходит перестройка водородных связей, поэтому плотность воды не уменьшается (как это обычно наблюдается для жидкостей), а увеличивается: лед легче воды. Аномалии воды имеют важное биологическое и географическое значение. Например, благодаря тому, что лед легче, водоемы не промерзают до дна; это защищает от вымораживания все живущие в воде организмы. Благодаря высокой теплоемкости (воду нелегко нагреть,
266
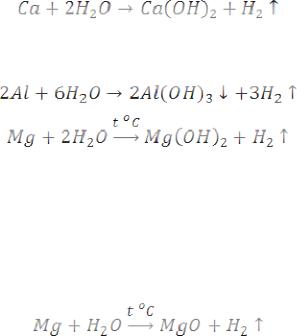
однако она и медленно остывает) вода оказывает сильное влияние на климат Земли: в приморских странах летом вода, поглощая огромное количество теплоты, уменьшает зной; зимой – она, наоборот, возвращает часть теплоты.
Теплые морские и океанические течения (например, Гольфстрим) смягчают климат омываемых ими стран (хороший пример – Англия, климат которой, несмотря на географическое положение, сравнительно мягкий.)
Вода имеет аномально высокие температуры кипения и плавления, объясняемые водородными связями между молекулами воды: при нагревании воды энергия затрачивается не только на повышение температуры (кинетической энергии молекул), но и на разрыв водородных связей и разрушение ассоциатов до более простых структур. Высокая полярность молекул воды приводит к тому, что в водных растворах ионные и полярные вещества распадаются на ионы (диссоциируют).
В химическом отношении вода относится к достаточно реакционноспособным веществам – она реагирует со многими простыми и сложными веществами.
Вода-окислитель. Щелочные и щелочно-земельные металлы энергично реагируют с водой при комнатной температуре с образованием щелочей и выделением водорода:
Аналогично, но с меньшей скоростью реагирует алюминий, очищенный от оксидной пленки:
( в холодной воде реакция идет медленно)
С парами воды при сильном нагревании Mg реагирует по уравнению:
267
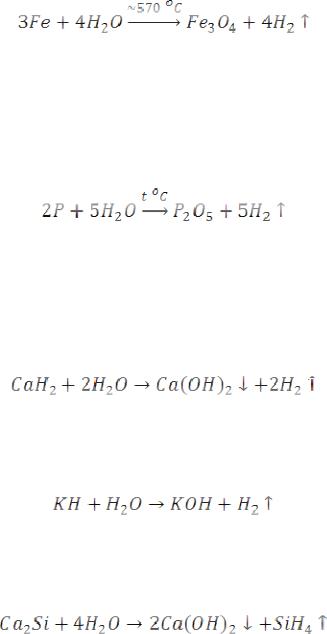
Остальные металлы, стоящие в ряду напряжений до водорода, разлагают воду при сильном нагревании с образованием водорода и оксида металла:
С металлами, расположенными в ряду напряжений после водорода, вода в отсутствие окислителей не реагирует.
При сильном нагревании вода окисляет некоторые неметаллы :
Роль окислителя вода выполняет при взаимодействии с гидридами и силицидами металлов:
Вода – восстановитель. Восстановительные свойства вода проявляет в реакциях с хлором (при сильном нагревании) и с фтором:
268
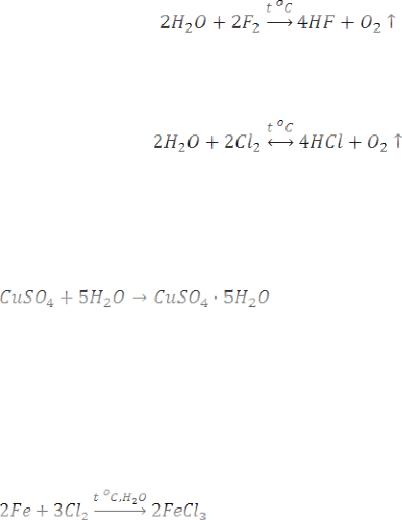
Полярность молекул воды и их малые размеры обусловливают ее гидратирующие свойства, т.е. способность присоединяться к ионам
имолекулам.
Внекоторых случаях гидратация настолько сильна, что при осторожном выпаривании растворов выделяются кристаллогидраты:
(медный купорос).
Вода вызывает гидролиз некоторых солей. Во многих процессах вода является катализатором. Например, абсолютно сухой хлор с железом не взаимодействует, реакция протекает только в присутствии следов влаги:
В отсутствие следов влаги алюминий не реагирует с йодом, водород не реагирует с хлором, а смесь водорода и кислорода не взрывается даже при сильном нагревании.
Велика биологическая роль воды. Вода – идеальная среда для таких процессов, как транспорт различных веществ в клетки живых организмов.
Вода – универсальный растворитель.Вода широко используется в качестве растворителя в химической технологии, а также в лабораторной практике. Вода прекрасно растворяет как ионные, так и ковалентные соединения. Способность воды хорошо растворять многие вещества обусловлена полярностью её молекул.
Природные воды представляют собой сложную многокомпонентную систему, в состав которой входят минеральные вещества, га-
269
зы, а также коллоидные и крупнодисперсные частицы, в том числе и микроорганизмы. По величине минерализации (%) различают следующие природные воды:
Ультрапресные – до 0,2; пресные – 0,2 – 0,5; слабоминерализованные – 0,5-1,0; солоноватые – 1-3; соленые – 3-10; с повышенной соленостью – 10-35; переходные к рассолам – 35-50; рассолы – более 50.
Макрокомпонентами природных вод являются Ca, Mg, Na, K, Fe (катионогенные воды); Si, C, S, Cl (анионогенные воды). К микроэлементам природных вод относятся редкие и рудные элементы, напри-
мер B, Li, Rb, Cu, Zn, Bi, Be, W, U, Br, Cl и др.
Основные газы, содержащиеся в природных водах: CO2, N2 (характерные как для поверхностных, так и глубинных вод); CH4, CO, H2 (более характерны для подземных вод и вод вулканических областей). Растворенные в воде компоненты находятся в равновесии, образуя комплексы различного состава.
В природе идет непрерывный круговорот воды. Вода, испаряясь, поступает в атмосферу, а затем выпадает в осадки над океаном(6575%) и сушей(35-25%). Природная вода находится в непрерывном взаимодействии с окружающей средой. Она реагирует с атмосферой, почвой, растительностью, минералами. При этом вода растворяет органические и неорганические соединения.
Все примеси природных вод можно подразделить на три группы (в зависимости от размеров частиц): истинно растворенные, коллоидные и взвешенные. Природные воды подлежат очистке от примесей перед использованием их для бытовых и технических нужд.
Водоподготовка – это комплекс технологических процессов обработки и очистки воды для приведения ее качества в соответствие с требованием потребителей. Водоподготовка включает следующие технологические процессы: осветление, обеззараживание, стабилизацию, умягчение, опреснение и обессоливание, обезжелезивание, обескремнивание, дегазацию.
Осветление. Вода поверхностных (открытых) источников, как правило, содержит крупнодисперсные и коллоидные минеральные и органические примеси, обусловливающие ее цветность. Для их удаления воду обрабатывают коагулянтами −Al2(SO4)3,FeSO4 , FeCl3 и флокулянтами (полиакриламидом, активной H2SiO3и др.). Образовавшуюся хлопьевидную массу, состоящую из гидроксидов Al и Fe и примесей, выделяют из воды в отстойниках.
270
