
химия + методичка / theory
.pdf
-высокая коррозионная стойкость (в 40 раз больше стали);
-сравнительная дешевизна и простота получения и обработки. Наиболее важные сплавы:
-Дюралюмины (Д 16): Al+5%Cu+1%Mg, Mn+0,5%Fe и Si – по-
лучают с помощью закалки и последующего старения.
-Силумины (Al + 10% Si).
-Магналий (Al + 11,5% Mg).
-Алюмель (2% Al + 2% Mn + 1% Si + 95% Ni) – широко приме-
няется для изготовления термоизмерительной аппаратуры. Алюминий и его сплавы используются для изготовления хими-
ческой аппаратуры, работающей в HNО3, NH3, сжиженном кислороде и азоте, ацетоне, пероксиде водорода H2O2 и др.
Алюминий – ценный электротехнический материал. Электропроводность провода из Al в два раза больше, чем провода равной массы из меди (т. к. Al в 3,5 раза легче Cu, хотя его электропроводность и составляет 60% от электропроводности меди).
Из алюминия производят фольгу (δ = 0,01 мм) для конденсаторов. Применяют алюминий для алитирования – насыщения поверх-
ности стальных или чугунных изделий алюминием для защиты от окисления при высоких температурах.
Алюминий широко используют в алюмотермии – восстановлении чистых металлов (Cr, V, Mn и др.) из их оксидов:
Cr2O3 + 2Al = Al2O3 + 2Cr.
Применяют Al для термической сварки (рельсы и др.) с помо-
щью термита (Al + 3Fe3O4):
8Al+3Fe3O4=4Al2O3+9Fe, ∆H= –3300 кДж (при этом развивается тем-
пература до 3000 ºС)
Важнейшие соединения алюминия:
1.Кристаллический оксид Al2O3 – корунд, обладает высокой твёрдостью и используется как абразивный материал, а также как адсорбент (поглотитель в различных отраслях промышленности).
Al2O3 красного цвета (примесь Cr2O3) – рубин, синего цвета (приме-
си Fe2O3 и TiO2) – сапфир – используются для украшений как драгоценные камни, для изготовления точных деталей приборов, камней в часах и т. д. Рубин широко используют в квантовых генераторах (лазерах), создающих поток монохроматического излучения.
2.Хлорид алюминия (AlCl3) – катализатор во многих органических синтезах (кислота Льюиса).
222
3.Сульфат алюминия – Al2(SO4)3∙18H2O – применяют для очистки воды (коагуляция примесей), в производстве бумаги и т. д.
4.Алюмокалиевые квасцы – K·Al(SO4)2·12H2O – применяют для дубления кож, в красильном деле для протравы хлопчатобумажных
тканей (образующийся при гидролизе квасцов Al(OH)3 отлагается в волокнах ткани в мелкодисперсном состоянии и адсорбирует краситель, прочно удерживая его на волокне).
14.2.Олово и свинец
Физические свойства:
|
ρ, г/см3 |
Т.пл., °С |
Т. кип., °С |
цвет |
Олово |
7,29…5,75 |
232 |
2362 |
серебристый |
Свинец |
11,34 |
327,5 |
1750 |
голубоватый |
Кроме белого олова, кристаллизующегося в гексагональной системе (ρ = 7,29), существует другое видоизменение его – серое олово, кристаллизующееся в кубической системе и имеющее меньшую плотность (ρ = 5,75).
Белое олово устойчиво при температуре выше 13,2°С. Серое олово устойчиво при температуре ниже 13,2 °С.
Поэтому при охлаждении белое олово превращается в серое. В связи со значительным изменением плотности металл при этом рассыпается в серый порошок. Это явление называют «оловянной чумой». Быстрее всего превращение белого олова в серое происходит при сильных морозах (ниже -30 °С).
Известен случай из Русско-Японской войны: на фронт привезли вагон котелков из олова, а выгрузили одну труху. Говорят, что одной из причин гибели Скотта в экспедиции к Южному полюсу была утечка керосина из банок, которые были запаяны оловом.
Олово обладает мягкостью и пластичностью и легко прокатывается в тонкие листы, называемые оловянной фольгой или станиолем.
Свинец очень мягок и режется ножом.
Нахождение в природе и получение. Содержание олова в земной коре 0,04 % масс. Основной минерал – оловянный камень (касситерит) SnO2. Олово из него получают восстановлением углем (коксом):
SnO2 + 2C = Sn + 2CO
Процесс протекает при сравнительно невысокой температуре, поэтому олово как легкоплавкий металл образуется в жидком состоя-
223
нии, а все примеси (шлак) – в твердом. Такой способ получения металлов называется зейгерованием.
Содержание свинца в земной коре 0,0016 % масс. Наиболее важная руда – свинцовый блеск РbS. Для получения свинца его сульфид подвергают обжигу, при этом сульфид превращается в оксид:
2PbS + 3O2 = 2PbO + 2SO2
Затем проводят так называемую конверторную плавку, при которой оксид восстанавливается углем или избытком сульфида:
2PbO + C = 2Pb + CO2
или
2PbO + PbS = 3Pb + SO2
Применение в технике.
1.Олово и свинец применяют с глубокой древности. Особую роль в истории материальной культуры сыграла бронза – сплав олова
смедью.
2.Около 30 % производимого олова расходуется для лужения,
т.е. покрытия им изделий из железа (белая жесть), соприкасающихся с продуктами питания, прежде всего – консервных банок. Это объясняется химической стойкостью олова, а также тем, что оно легко наносится на железо и обладает хорошей сцепляемостью (адгезией) со сталью. Кроме того, что очень важно, продукты его коррозии безвредны для человека.
3.Значительная часть олова (59 %) расходуется на производство оловянных баббитов (сплавов с сурьмой и медью, которые широко применяются для изготовления подшипников скольжения), получения латуней, бронз, сплавов с цирконием (для атомных реакторов), с титаном (для турбин), с ниобием (Nb) для сверхпроводников и др.
4.Сплавы олова со свинцом – достаточно распространенные припои.
Свинец также широко используется в технике:
1.Наибольшее количество свинца идет на изготовление оболочек силовых кабелей, а также пластин свинцовых аккумуляторов (55
%всего производимого свинца).
2.В производстве H2SO4 из свинца изготавливают кожухи башен, змеевики холодильников и др.
3.Достаточно много свинца расходуется на производство боеприпасов.
224

4.Свинец хорошо поглощает γ-лучи, поэтому его используют для защиты при работе с радиоактивными веществами.
5.Свинец применяют также для производства некоторых видов подшипников.
Раньше свинец широко использовали для производства тетраэтилсвинца – антидетонатора моторного топлива (см. выше). Однако,
всвязи с загрязнением воздуха токсичными выбросами, содержащими свинец, в последнее время его заменяют другими присадками, хотя и менее эффективными, но не содержащими свинец.
Любопытно отметить, что в теле первобытного человека было 2 мг свинца, а в теле современного человека – 100 мг. В Кремле в XIIIXVII в.в. был свинцовый водопровод, отсюда, по мнению некоторых ученых, – слабоумные цари.
Химические свойства. Олово и свинец относятся к IV-A группе периодической системы. Их атомы, отличаясь друг от друга числом
внутренних электронных уровней, имеют одинаковую электронную конфигурацию внешнего уровня – s2p2.
В нормальном состоянии они содержат на внешнем уровне по
два парных s-электрона и по два непарных p-электрона. В возбужденном состоянии их электронная конфигурация иная – s1p3, а все электроны – непарные. Например:
|
5s |
|
5p |
+E |
|
5s |
|
5p |
|||
|
|
|
|
|
|
|
|
|
|||
50Sn |
|
|
|
|
возбужде- |
50Sn* |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
невозбужденное |
ние |
|
возбужденное |
||||||||
состояние |
|
|
состояние |
||||||||
Таким образом, максимальная валентность этих элементов равна IV. Однако, известны соединения, в которых валентность Sn и Pb равна II.
Хотя олово и свинец представляют собой металлы, однако типичные для металлов свойства выражены у них довольно слабо.
а) На воздухе при обычной температуре олово вполне устойчиво, т.к. покрывается тонкой оксидной пленкой, обладающей защитными свойствами. Свинец так же постепенно покрывается оксидной пленкой, которая предохраняет его от дальнейшего окисления.
б) При высоких температурах олово и свинец взаимодействуют с кислородом, галогенами, серой:
225
t 0C
Sn + O2 = SnO2 (диоксид олова),
t 0C
2Pb + O2 = 2PbO (монооксид свинца – глёт),
t 0C
Sn + 2CI2 = SnCI4 (тетрахлорид олова),
t 0C
Pb + CI2 = PbCI2 (хлорид свинца),
t 0C
Sn + 2S = SnS2 (дисульфид олова),
t 0C
Pb + S = PbS (сульфид свинца).
в) С азотом оба металла непосредственно не реагируют.
г) Вода на олово при обычной температуре не действует. Свинец под действием воды (особенно при высокой температуре) постепенно окисляется, т.к. вода растворяет защитную оксидную пленку:
t 0C
2Pb + O2 + 2H 2O = 2Pb(OH )2
д) Отношение к кислотам:
1. Олово медленно реагирует с разбавленными кислотами; лучше процесс идет с HCl:
Sn + 2HCI = SnCI2 + H2 −
Значительно энергичнее протекает эта реакция, если через раствор продувать кислород (т.е. в присутствии окислителя):
2Sn + 4HCI + O2 = 2SnCI 2 + 2H 2O
2. Свинец растворяется во многих кислотах, но их действие ослабляется из-за образования на его поверхности пленок сульфата свинца PbSO4, хлоридов свинца и т.д.
Pb + 2HCI + O2 = PbCI2 ↓ +H2 −
Pb + H2SO4 ( p) = PbSO4 ↓ +H2 −
3. Легко реагирует свинец с разбавленной HNO3 , т.к. нитрат свинца хорошо растворим, а значит, защитной пленки не образует:
3Pb + 8HNO3( p) = 3Pb(NO3 )2 +2NO + 4H2O
4. Концентрированная HNO3 окисляет оба металла:
Pb + 4HNO4(к.) = Pb(NO3 )2 + 2NO2 + 2H2O
226
причем при взаимодействии с оловом образуется метаоловянная кислота, которая не растворяется ни в кислотах, ни в щелочах:
Sn + 4HNO3(к.) = H2SnO3+4NO2 + H2O
5. Концентрированная серная кислота окисляет олово, сама восстанавливаясь до SO2:
Sn + 2H2SO4(к.) = SnSO4 +SO2 + 2H2O .
Свинец же не окисляется из-за образования нерастворимой сульфатной пленки.
е) Отношение к щелочам.
Оба металла реагируют с растворами щелочей с образованием комплексных соединений, например:
Pb + 4KOH + 2H2O = K4[Pb(OH )6 ] + H 2 − – гидроксоплюмбат калия.
Все растворимые соединения свинца ядовиты.
Важнейшие соединения олова и свинца :
-ацетат свинца (II) – Pb(CH3COO)2 – применяется для крашения тканей;
-диоксид свинца PbO2 – находит применение в качестве окислителя в химической промышленности;
-смешанный оксид свинца (Pb3О4 = 2PbO·PbO2) – на его основе готовят краску, применяемую для защиты металлов от коррозии («свинцовый сурик»);
-сульфид свинца (PbS) – полупроводниковый материал в электронике и радиотехнике;
-селенид свинца PbSе – полупроводниковый материал для фоторезисторов, фотоприемников и излучателей в инфракрасном диапазоне;
-диоксид олова SnO2 – применяют для изготовления глазурей и эмалей;
-гидроксостаннат натрия – Na2[Sn(OH)6] – применяют как протраву в красильном деле и для утяжеления шелка. Шелковые ткани, обработанные им перед крашением, содержат иногда олово в количестве до 50% от веса ткани;
-дисульфид олова SnS2 – имеет вид золотисто-желтых чешуек и как имитатор сусального золота употребляется для «золочения» дерева, гипса и др.;
227
-дифторид олова SnF2 – компонент зубных паст, флюсов для пайки, твердых электролитов и электролитов для лужения;
-теллурид олова SnTe – полупроводниковый материал для термоэлектрических генераторов;
-тетрахлорид олова SnCl4 применяют для получения оловоорганических соединений, как катализатор полимеризации, протрава при крашении тканей, для утяжеления натурального шелка и т.д.
ГЛАВА 15 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИИ d -
ЭЛЕМЕНТОВ
Электронная структура. Атомы большинства d-элементов имеют на внешнем слое по два s-электрона и на предвнешнем слое – от одного до десяти электронов [(n-1)d1-10ns2]. Исключение составляют
атомы первой группы [(n-1)d10ns1], некоторые атомы VI группы (Сr – 3d54s1, Mo – 4d55s1) и VIII группы (Ru – 4d75s1,Rh – 4d85s1, Pt – 5d96s1), у
которых на внешнем уровне имеется лишь по одному s-электрону (происходит "провал" одного s-электрона на d-подуровень). У палладия внешний s-подуровень не заполнен (Pd – 4d105s0). В периодической системе d-элементы находятся в середине периода между s- и p- элементами и называются переходными металлами. Формирующими у них являются d-электроны.
Разность между энергиями ns-, пр- и (п-1) d- электронами невелика, поэтому при образовании простых веществ (металлов) вместо ns- и пр- и частично (n-1) d-уровней возникают зоны проводимости, в которых размещаются нелокализованные (обобществленные) электроны. Образование зон проводимости, не полностью заполненных нелокализованными электронами, и обусловливает металлическое состояние этих веществ. Число нелокализованных электронов в зоне проводимости у различных d-элементов колеблется в небольших пределах (от 1,5 до 2,5 на атом), поэтому d-металлы кристаллизуются, как правило, в кубической или гексагональной решетках. Наличие обобществленных электронов обусловливает металлические свойства d-элементов: электрическую проводимость, теплопроводность, металлический блеск и ковкость.
К важной особенности d-элементов относится образование ковалентной связи между соседними атомами за счет d-электронов, что существенно влияет на свойства этих металлов. Так как число d- электронов изменяется по периоду, то соответственно изменяются физические и химические свойства металлов. С увеличением поряд-
228

кового номера элемента в одной и той же группе периодической системы изменяется электронная структура металлов в силу нескольких причин: появления вакантных подуровней (сначала f, а затем и g), проникновения s-электронов под экран d-, а затем d- и f-электронов, f- сжатия в шестом периоде. Поэтому свойства d-металлов пятого и шестого периодов заметно отличаются от свойств элементов четвертого периода.
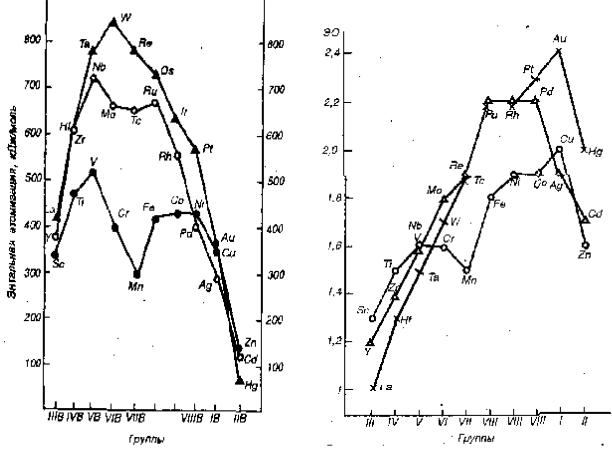
Физические свойства. На физические свойства простых веществ заметно влияет число неспаренных d-электронов в предвнешнем слое, которые могут образовать локализованную связь. Максимальную температуру плавления имеют элементы V – VI групп, обладающие по 3 – 4 неспаренным d-электронам (рис. 15.1). Эти же элементы характеризуются максимальной энтальпией атомизации (энергией превращения металла в газообразное состояние, рис. 15.2).
Рис. 15.1 Изменение температуры плавления d-элементов по группам
Заметное снижение температуры плавления и энергии атомизации, наблюдаемое у марганца и технеция, обусловлено особенностями электронной структуры этих металлов (завершением заполнения атомных орбиталей d-подуровня по одному электрону). Металлы, имеющие на внешнем s-подуровне один электрон, как правило имеют более высокую электрическую проводимость (Сr, Мо и особенно Сu,
229
Ag, Аu). Элементы III группы, имеющие всего один d-электрон, по своим свойствам близки к соседним щелочноземельным металлам, a d-элементы II группы с полностью заполненным d-подуровнем близки по свойствам к своим соседним p-элементам (подгруппы галлия).
Химические свойства. Все d-элементы являются восстановителями. Кривые зависимости электроотрицательности (рис. 15.3) от номера группы и стандартных электродных потенциалов от порядкового номера элемента в периоде проходят через максимум у металлов VIII- I групп. Наиболее сильными восстановителями являются элементы III группы, а также цинк и кадмий (II группа). Соответственно для всех d-элементов, кроме платиновых металлов и металлов I группы, термодинамически вероятна коррозия с выделением водорода в растворах кислот. Однако у большинства d-элементов образуются защитные оксидные пленки, вызывающие их пассивацию и предохраняющие от коррозии. Наиболее склонны к пассивации металлы IV – VI групп. Элементы III и II групп (кроме ртути) легко взаимодействуют с разбавленными кислотами, а некоторые, например лантан, и с водой.
Рис. 15.2 – Изменение энтальпии иониза- |
Рис. 15.3 – изменение электроотрицатель- |
ции d-элементов по группам |
ности d-элементов по группам |
|
230 |

 S↓ + Al
S↓ + Al H
H