
химия + методичка / theory
.pdfа) Кинетическая устойчивость – это способность частиц к самостоятельному тепловому движению в растворе (“броуновское” движение).
Кинетическая устойчивость тем выше:
1)чем меньше размер частиц;
2)чем меньше вязкость дисперсионной среды;
3)чем выше температура.
Грубодисперсные системы кинетически неустойчивы. Их частицы не способны к заметному самопроизвольному тепловому движению. С течением времени они расслаиваются на слой дисперсной фазы и слой дисперсионной среды. Процесс расслоения дисперсной системы называется седиментацией.
Истинные растворы кинетически вполне устойчивы, а коллоидные растворы занимают промежуточное положение между истинными растворами и грубодисперсными системами. Обычно коллоидные растворы кинетически устойчивы и разрушение их начинается после того, как нарушается их агрегативная устойчивость.
б) Агрегативная устойчивость – выражается в том, что частицы не укрупняются (не слипаются) при столкновениях друг с другом.
Процесс слипания частиц в более крупные агрегаты называется коагуляцией. Так, коллоидный раствор (золь), лишенный агрегативной устойчивости, коагулирует и выпадает в осадок, т.е. превращается в
гель.
Гель почти не имеет текучести (студнеобразная масса). При долгом стоянии гели сжимаются, выделяя воду. Это явление (т.е. разделение геля на две фазы) называется синерезисом.
Вещества, связывающие при коагуляции значительное количество растворителя, называются лиофильными коллоидами. (Если растворитель – вода, то гидрофильными – растворы мыла, белков и т.д.). Гель таких коллоидов – студенистый.
Если же вещества связывают незначительные количества растворителя (сера, сульфиды, хлориды и др.), их называют лиофобными (гидрофобными). Гель таких коллоидов – порошкообразный, сыпучий.
Таким образом, вместе с утратой агрегативной устойчивости система становится кинетически неустойчивой.
6.3. Виды поверхностных явлений
Поглощение вещества одной фазы другой фазой называется сорбцией. (Поглощающее вещество – сорбент, а поглощаемое веще-
ство – сорбат.)
111
К таким процессам относятся, например, поглощение газообразных или растворенных веществ твердыми (или жидкими) телами из окружающей среды.
Процесс поглощения, который, начинаясь на поверхности раздела фаз, распространяется по всему объему, называется объемным поглощением или абсорбцией (например, растворение газа в жидкости).
Явление, когда поглощаемое вещество концентрируется только в пограничном слое у поверхности раздела фаз, называется поверхностным поглощением или адсорбцией (поглощающее вещество – ад-
сорбент, поглощаемое – адсорбат).
Взаимодействие между частицами адсорбата и адсорбента может быть различным. В зависимости от природы возникающих при адсорбции взаимодействий различают:
а) Физическую адсорбцию – частицы адсорбата и адсорбента связываются относительно непрочными связями – силами Ван-дер- Ваальса.
б) Хемосорбцию – частицы связываются более прочными силами сцепления за счет химического взаимодействия (например, поглощение аммиака водой).
ГЛАВА 7. РАСТВОРЫ
Самопроизвольное распределение одного вещества в другом в результате диффузии приводит к образованию растворов. При этом происходит диспергирование веществ – компонентов раствора – до состояния молекул, ионов или атомов.
Растворы имеют важное значение в жизни и практической деятельности человека. Так, процесс усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и др.). Производства, в основе которых лежат химические процессы, обычно связаны с использованием растворов.
Раствором называется термодинамически устойчивая однофазная конденсированная система переменного состава, состоящая из двух или большего числа компонентов.
Любой раствор состоит из растворителя и растворённого вещества.
Растворитель – это вещество, агрегатное состояние которого при образовании раствора не меняется.
112
Если один из компонентов раствора – жидкость, а другой – твёрдое вещество или газ, то растворитель – жидкость, независимо от того, какой из компонентов преобладает в растворе.
При одинаковом агрегатном состоянии обоих компонентов обычно растворителем считают то вещество, которое преобладает в растворе. Исключение – вода, которая всегда является растворителем, независимо от соотношения компонентов.
Наибольшее значение имеют жидкие растворы, в которых растворителем является вода. (Растворы газов в газах чаще всего называют не газовыми растворами, а газовыми смесями).
При растворении вещества происходят два процесса – разрушение структуры растворяемого вещества и взаимодействие молекул растворителя с частицами растворяемого вещества. Оба процесса связаны с изменением энергии системы: растворённое вещество – растворитель.
На разрушение структуры растворяемого вещества затрачивается определённая энергия (эндотермический процесс), а при взаимодействии молекул растворителя с частицами растворённого вещества энергия выделяется (экзотермический процесс).
В зависимости от соотношения величин этих тепловых эффектов процесс растворения вещества может быть эндо – или экзотерми-
ческим.
Растворение в жидкостях газов и жидкостей обычно сопровождаются выделением теплоты ( Н<0); растворение твёрдых веществ в большинстве случаев – процесс эндотермический ( Н>0).
Энтропия при растворении твёрдых веществ, как правило, уве-
личивается ( S>0), а при растворении газов – уменьшается ( S<0).
7.1. Концентрация растворов. Способы выражения концентрации растворов
Концентрацией раствора называется количество растворённого вещества, содержащееся в определённом количестве (массы или объема) раствора или растворителя.
Раствор, в котором при данных условиях содержится максимально возможная масса растворённого вещества, называется насыщенным. Насыщенный раствор находится в равновесии с избытком растворённого вещества.
Если концентрация раствора меньше концентрации насыщенного раствора, то он называется ненасыщенным, а если больше – пересыщенным. Пересыщенные растворы неустойчивы, поэтому встряхи-
113

вание или введение в раствор кристаллика соли вызывает выпадение в осадок избытка растворённого вещества.
В большинстве случаев применяют ненасыщенные растворы (часто растворы с большой концентрацией называют концентрированными, а с малой – разбавленными. Чёткой границы между ними нет, хотя условно принимают, что концентрированные растворы имеют концентрацию более 10%).
Наиболее распространённые способы выражения концентрации растворов:
Массовая доля растворённого вещества (массовый процент, процентная концентрация) – С,%.
Определяется числом массовых частей (г, кг и т.д.) растворённого вещества в 100 массовых частях раствора.
Например, 20%-ный раствор NaCl – это раствор, в 100 г которого содержится 80 г воды и 20 г NaCl.
Процентную концентрацию можно рассчитать по формуле:
C, % = |
mр.в. |
×100% |
(7.1) |
|
mр.в. + mр− ля |
||||
|
|
|||
|
|
|
где: mр.в. – масса растворённого вещества, г, кг и т.д.; mр-ля. – масса растворителя, г, кг и т.д.
Пример: В 270 г воды растворено 30 г сахара. Определить массовый процент раствора:
|
C, % = |
30 |
×100% =10% |
или: |
30 + 270 |
||
масса раствора 270+30=300 г. |
|||
значит, в 300г раствора содержится 30 г сахара, а в 100г – Х отсюда:
Х = 100×30 =10г 100
т.е. раствор 10%-ный.
2. Молярная концентрация (молярность) – См , моль/л, М. Оп-
ределяется числом молей растворённого вещества, содержащихся в
одном литре раствора.
Так, 2М Н2SO4 (двумолярный раствор) означает раствор Н2SO4, в каждом литре которого содержится 2 моля, т.е. 2∙98=196г Н2SO4.
1М – одномолярный раствор; 0,1М – децимолярный раствор;
114

0,01М – сантимолярный раствор; 0,001М – миллимолярный раствор. Молярную концентрацию можно рассчитать по формуле:
CM = |
n |
|
CM = |
|
mр.в. |
||
|
или |
|
|
(7.2) |
|||
|
M |
|
|||||
V |
|||||||
|
|
|
р.в. ×Vр− ра |
||||
где: n – количество растворённого вещества, моль; V – объём раствора, л; mр.в. – масса растворённого вещества, г; Мр.в. – молярная масса растворённого вещества, г/моль.
Пример: Вычислить молярную концентрацию раствора, в 200 мл которого содержится 16 г NaOH.
Решение:
Находим массу NaOH в 1 л раствора:
в 200мл − 16г NaOH
в 1000мл − Х
Х = 1000×16 = 80г 200
Молярная масса NaOH равна 40 (23+16+1=40). Число молей, содержащихся в 80 г NaOH: n=80/40=2, следовательно, имеем 2М (двумолярный) раствор NaOH. Или (из формулы 7.2):
CM = |
16 |
= 2 моль/ л |
|
40×0,2 |
|||
|
|
3. Моляльная концентрация (моляльность – Сm , моль/кг, m).
Определяется числом молей растворённого вещества, содержащихся в 1 кг чистого растворителя. Например, 2m H2SO4 означает раствор, в котором в 1000г воды растворено 2 моля H2SO4 (т.е. 98∙2=196г.)
Моляльную концентрацию можно рассчитать по формуле:
Cm = |
mр.в. ×1000 |
моль / кг |
(7.3) |
|
M р.в. ×mр− ля |
||||
|
|
|
где: mр.в. – масса растворённого вещества (г, кг); mр-ля. – масса растворителя (г, кг); Мр.в. – молярная масса растворённого вещества (г/моль).
Пример: Определить моляльную концентрацию 20%-ного раствора NaOH.
Решение: Данный раствор имеет состав: 20 г NaOH и 80 г Н2О.
Из (7.3):
115

Cm = 20×1000 = 6,25 моль/ кг. 40×80
4. Молярная доля компонента в растворе (молярная доля) – Nі. Определяется отношением числа молей данного компонента к сумме чисел молей всех компонентов, имеющихся в растворе.
Ni = |
ni |
(7.4) |
|
Sn |
|||
|
|
Так, в бинарном растворе, состоящем из веществ А и В (“nA“ молей вещества А и “nB“ молей вещества В) молярные доли NА и NВ соответственно равны:
NB = |
|
nB |
; |
NA = |
nA |
; |
|
nA |
+ nB |
nA + nB |
|||||
|
|
|
|
Пример: Определить молярную долю NaOH в 10%-ном растворе
NaOH.
Решение: Состав раствора: 10г NaOH и 90г H2O.
Число молей: |
n |
NaOH |
= |
10 |
= 0,25; n |
|
|
= |
90 |
= 5; |
|||
|
|
|
|
||||||||||
|
|
40 |
|
H 2O |
18 |
|
|
||||||
|
|
|
|
nNaOH |
|
|
|
|
|
||||
|
NNaOH |
= |
|
|
= |
|
0,25 |
|
= 0,047. |
||||
|
nNaOH + nH 2O |
|
0,25 + |
5 |
|||||||||
|
|
|
|
|
|
|
|
||||||
5. Молярная концентрация эквивалента вещества (эквивалент-
ная, нормальная концентрация, нормальность) – Сн , моль/л (в формулах обозначается н.). Определяется числом эквивалентных масс растворённого вещества, содержащихся в 1 л. раствора.
Так, 1н. Н2SO4 обозначает раствор кислоты, в 1 литре которого содержится 1 эквивалентная масса Н2SO4 (эквивалентная масса ки-
слоты равна отношению молярной массы кислоты к её основности,
т.е. числу атомов водорода в молекуле кислоты). Следовательно, в 1л. раствора содержится 98/2=49г Н2SO4.
Cн = |
mр.в. |
|
|
(7.5) |
|
|
||
|
mэ.( р.в.) ×Vр− ра |
|
где mр.в. – масса растворённого вещества (г, кг); mэ.(р.в.) – эквивалентная масса растворённого вещества (г/моль); Vр-ра. – объём раствора (л).
116

Пример: Вычислить нормальность раствора гидроксида кальция Ca(OH)2, в 200 мл. которого содержится 20 г Ca(OH)2
Решение: Находим массу Ca(OH)2 в 1 литре раствора
200мл − 20г
1000мл − Х
Х = 1000×20 =100г Ca(OH)2 200
Эквивалентная масса
Ca(OH) = |
MCa(OH ) |
2 |
= |
(40 + 2×17) |
= 37г / моль |
|
|
|
|||
2 |
2 |
|
|
2 |
|
|
|
|
|
(Эквивалентная масса основания равна его молярной массе, делённой на число гидроксидных групп ОН). Число эквивалентных масс в 100г:
Cн = 10037 = 2,7
или из (7.5): Cн = 3720× 0,2 = 2,7
Следовательно, раствор 2,7 – нормальный. Обозначают:
1н. – однонормальный раствор;
0,1н. – децинормальный раствор; 0,01н. – сантинормальный раствор и т.д.
Закон эквивалентов для растворов:
Объёмы растворов реагирующих веществ обратно пропорцио-
нальны их нормальностям.
V1 :V2 = CН2 : CН1
или
V1 ×CН1 = V2 ×CН2 |
(7.6) |
6. Титр раствора – Т (г/см3 или г/мл).
Определяется числом граммов растворённого вещества содержащихся в 1 см3 (1 мл) раствора.
T = |
mр.в. |
|
(7.7) |
||
|
Vр− ра ( мл) |
|
Между титром, нормальностью и эквивалентной массой растворенного вещества существует соотношение:
117
T = |
Cн × mэ |
(7.8) |
|
||
1000 |
|
|
где: Сн – нормальность раствора, моль/л; mэ – эквивалентная масса растворённого вещества, г/моль.
7.2. Растворимость
Растворимость – это способность одного вещества раство-
ряться в другом. Количественно растворимость выражается концентрацией насыщенного раствора (г/100г растворителя). Растворимость в воде выражают в граммах вещества на 100 г воды (г/100 г Н2О).
По растворимости в воде вещества делят на 3 группы: Легкорастворимые – растворимость более 1г в 100 г Н2О. Малорастворимые – растворимость от 0,001 до 1г в 100г Н2О.
(например, PbCl2 – растворимость 0,97г в 100г Н2О).
Практически нерастворимые – растворимость менее 0,001г в
100г Н2О (например, BaSO4 – растворимость 0,00025г в 100г Н2О.)
Абсолютно нерастворимых веществ в природе не существует.
(Если опустить в воду стеклянную палочку или кусочек золота, то они в ничтожных количествах всё же растворяются в воде – поэтому их и называют практически нерастворимыми).
а) Растворимость газов в жидкости увеличивается с повышением давления и понижением температуры. Зависимость раствори-
мости газа от давления выражается законом Генри:
При постоянной температуре растворимость газа в жидкостях прямо пропорциональна давлению газа над жидкостью:
c = k × p |
(7.9) |
где: с – концентрация газа в насыщенном растворе (г/л или см3газа/см3 растворителя); k – коэффициент Генри (зависит от природы компонентов раствора); р – давление газа над жидкостью.
Растворимость газов, находящихся в смеси, описывается законом Генри-Дальтона:
Если над данной жидкостью находится смесь газов, то каждый из них растворяется в жидкости пропорционально своему парциаль-
ному давлению.
c = ki × pi |
(7.10) |
где: рi – парциальное давление данного компонента; ki – коэффициент Генри для данного компонента.
118
Это уравнение называют уравнением изотермы растворимости. Зависимость растворимости газа от температуры при постоян-
ном давлении выражается уравнением изобары растворимости.
lg C = A − |
B |
, |
(7.11) |
T |
где: Т – абсолютная температура; А и В – коэффициенты, характеризующие раствор.
Закон Генри строго соблюдается только при низких давлениях и для идеальных газов, когда они не вступают в химическое взаимодействие с растворителем.
б) Растворимость жидкости в жидкости – обычно увеличива-
ется с повышением температуры и почти не зависит от давления. Лишь при высоких давлениях (порядка тысячи атмосфер) растворимость начинает возрастать.
Жидкость в жидкости может растворяться: -неограниченно (спирт+вода); -ограниченно (вода+фенол); -совсем не растворяться (вода+бензол).
Жидкости, которые ограниченно растворяются друг в друге, расслаиваются. Но так как с повышением температуры растворимости обычно возрастают, то при некоторой температуре происходит их полное растворение. Эта температура называется критической тем-
пературой растворения. Так, для системы фенол – вода критическая температура равна 66°С, выше этой температуры расслаивание исчезает и жидкости растворяются друг в друге в любых отношениях.
в) Растворимость твёрдого тела в жидкости при постоянном давлении увеличивается с повышением температуры (но бывают и исключения).
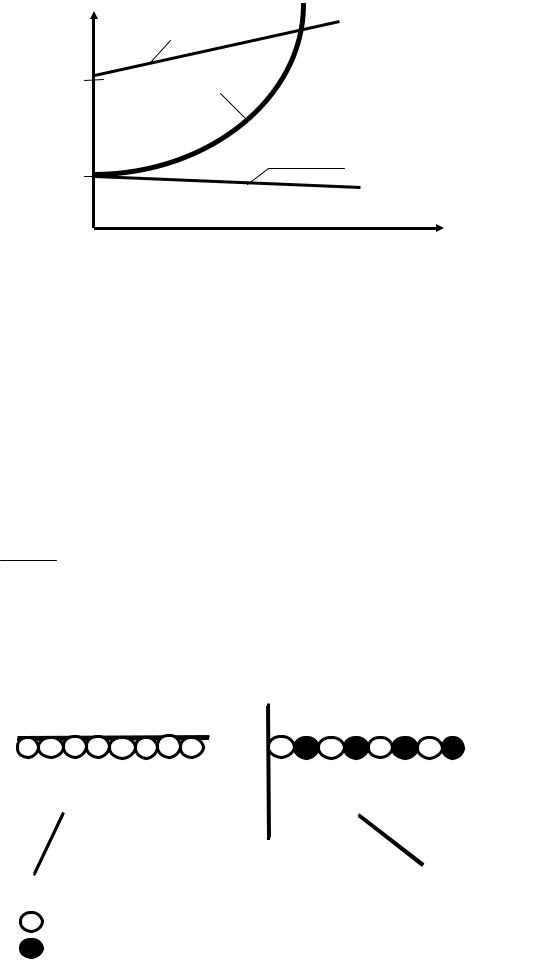
Для удобства и наглядности зависимость растворимости от условий равновесия изображают графически – с помощью кривых растворимостей, которые строят в координатах: температура (абсцисс) – растворимость (г/100 г растворителя) (см. рис 7.1).
Растворимость NaCl в воде с ростом температуры увеличивается очень незначительно: при повышении температуры от 0 до 100 ºС растворимость увеличивается всего лишь на 11,5%. Гидроксид кальция Ca(OH)2 является одним из исключений – с ростом температуры его растворимость в воде уменьшается.
119
y |
|
|
NaCl |
|
|
|
|
||
25 |
|
|
KNO 3 |
|
15 |
|
|
|
|
|
|
|
|
|
Ca (OH ) 2
5
x
t ,° C
Рис. 7.1. Кривые растворимости твёрдых тел в воде:
x– температура, °С; y – растворимость (г/100г H2O).
7.3.Давление пара растворов. Первый закон Рауля
При растворении какого-либо нелетучего вещества в растворителе активная поверхность испарения снижается вследствие того, что часть ее будет занята молекулами растворённого вещества. В результате будет уменьшаться испарение растворителя, а значит, и парциальное давление его насыщенных паров над раствором, т.е. Р0>Р, где: Р0 – давление пара над чистым растворителем; Р – давление пара растворителя над раствором; (Р0-Р) – понижение давления насыщенного пара растворителя над раствором.
P0 − P
P0 - относительное понижение давления пара растворителя
над раствором.
Рауль в 1887 г. экспериментально установил: Относительное понижение давления насыщенного пара растворителя над раствором прямо пропорционально молярной доле растворённого вещества.
P0 |
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
Чистый растворитель |
Раствор |
|
- |
молекулы растворителя |
|
- |
молекулы растворенного вещества |
|
120
