
химия + методичка / theory
.pdf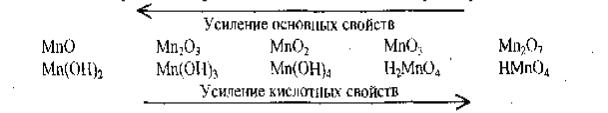
Общим свойством соединений почти всех d-элементов является переменная степень окисления. Так как на внешнем слое у большинства d-элементов находятся два s-электрона, то они проявляют степень окисления +2. Высшая степень окисления у элементов, не содержащих на орбиталях пар d-электронов (III – VII группы), соответствует номеру группы. Для элементов VIII группы, у которых d- орбитали имеют электронные пары, высшие степени окисления не характерны. Исключение составляют рутений и осмий, проявляющие высшие степени окисления +8. В связи с переменными степенями окисления для большинства d-элементов характерны окислительновосстановительные реакции.
Строение и свойства соединений d- элементов зависят от степени окисления атомов. Соединения металлов низшей степени окисления (обычно +2, иногда +1) с сильными окислителями имеют, как правило, ионный характер. Соединения многих d-элементов со слабыми окислителями (N, В, С, Н, S, Si) являются металлоподобными веществами. Они обладают электрической проводимостью, некоторые из них (NbxNy, NbxCy и др) и сверхпроводимостью при низких температурах. Большинство соединений с низшей степенью окисления металлов – восстановители. В соединениях высшей степени окисления металлов химические связи относятся к полярно-ковалентным. Например, в молекуле TiCl4 хлор образует ковалентные связи с четырьмя гибридизованными (d2sp)-орбиталями титана. При обычных условиях TiCl4 – жидкость. Соединения d-элементов высшей степени окисления – сильные окислители (KMnO4, K2CrO4 и др.). С увеличением степени окисления атомов в оксидах и гидроксидах усиливается кислотный характер последних:
Оксид марганца МnО является основным, гидроксид Мn(ОН)4 – амфотерным соединением, а НМnO4 – очень сильная кислота.
Так как атомы d-элементов и их ионы имеют большое число вакантных орбиталей внешнего (р- и s-орбитали) и предвнешнего слоев (d- и у многих f-орбиталей) и относительно небольшой радиус, то для них характерна склонность к комплексообразованию. Они могут об-
231
разовывать комплексы нейтрального, например Мn(СО)5, катионного, например [Cd(NH3)4]2+, и анионного, например Fe(CN)6]3-, характера. Прочность комплексов с одинаковыми лигандами возрастает с увеличением заряда иона металла и уменьшением его радиуса, в одном и том же периоде при перемещении вправо от VI до I группы.
Так как d-металлы и их ионы имеют неспаренные электроны, способные при поглощении световой энергии переходить из основных энергетических уровней и подуровней на более высокие уровни (в возбужденное состояние), то большинство ионов и их соединений окрашены в тот или иной цвет. Окраска зависит от разности энергии основного и возбужденного состояний и соответственно длин волн поглощаемого света. В свою очередь, разность энергий определяется электронным строением ионов d-элементов, характером лигандов.
|
Окраска ионов некоторых d-элементов |
Т а б л и ц а 1 5 . 1 |
||
|
|
|||
|
|
|
|
|
Ион |
|
Окраска |
Ион |
Окраска |
Ti3+ (водн.) |
|
Пурпурная |
Со2+ (водн.) |
Розовая |
Сг3+ (водн.) |
|
Фиолетовая |
[Co(NH3)6]3+ |
Оранжевая |
CrO42− (водн.) |
|
Желтая |
[CO(NH3)5C1]2+ |
Пурпурная |
Cr2O72− (водн.) |
|
Оранжевая |
[СоС14]2- |
Голубая |
Мn2+ (водн.) |
|
Розовая |
Ni2+ (водн.) |
Зеленая |
MnO4− (водн.) |
|
Пурпурная |
[CuCl4]2- |
Желтая |
Fe2+ (водн.) |
|
Светло-зеленая |
Cu2+ (водн.) |
Голубая |
Цвет драгоценных камней (аквамарин, аметист, бирюза, гра-
нат, изумруд, рубин, топаз и др.) объясняется окраской примесных ионов d-металлов (Fe3+, Cr3+, Сu2+, Мn3+ и др.).
Многие d-металлы, особенно металлы VIII и I групп являются катализаторами различных реакций.
15.1.Титан
Титан по внешнему виду напоминает сталь. Плотность ρ = 4,5г/см3, t.пл. = 1668 °С, t.кип. = 3210 °С.
Нахождение в природе и получение. Содержание титана в земной коре достаточно велико (0,6% масс.). Это гораздо больше, чем
Cu, Pb, Zn и др.
Важнейшие минералы:
-титаномагнетиты (FeTiO3·nFe3O4);
-ильменит (FeTiO3);
232

- рутил (TiO2).
Вначале руду переводят в диоксид титана TiO2, который затем хлорируют при 800…1000°С в присутствии углерода, связывающего кислород:
TiO2 + 2Cl2 + 2C = TiCl4 + 2CO.
Получающийся хлорид титана TiCl4 восстанавливают магнием: TiCl4 + 2Mg = Ti + 2MgCl2
Процесс ведут при 900 °C в атмосфере инертного газа (Ar или He) в герметичных стальных аппаратах (т. к. титан при высоких температурах активно реагирует с кислородом, азотом, углеродом, то применяют инертные газы). Титан получается в виде губчатой массы, загрязнённой примесями. После соответствующей очистки титановую губку подвергают переплавке в атмосфере инертного газа или в глубоком вакууме.
Для получения небольших количеств титана высокой чистоты применяют галидный метод (см. выше).
Химические свойства. Титан входит в IV–B группу периодической системы. Его атомы имеют электронную конфигурацию 4s23d2. Значит, в возбужденном состоянии он проявляет максимальную валентность, равную IV:
|
|
3d |
4s 4p |
+E |
|
|
3d |
4s 4p |
|||||||||||||
Ti |
|
|
|
|
|
|
|
|
|
возбуждение |
Ti* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
невозбужденное |
возбужденное |
||||||||||||||||||||
|
|
|
|
||||||||||||||||||
|
|
состояние |
|
|
|
|
|
|
|
состояние |
|
|
|
|
|||||||
Особенностью титана является то, что его восстановительная способность очень сильно зависит от температуры – при обычной температуре она очень низка (высокая коррозионная стойкость), а при tпл. – одна из самых высоких среди металлов.
С галогенами титан образует тетрагалиды:
toC
Ti + 2Cl2 = TiCl4
При температуре выше 300 °С реакция идет очень энергично. На воздухе титан очень устойчив к кислороду. При 1200…1300 °С
реагирует с кислородом очень бурно.
233
toC
Ti + O2 = TiO2 – яркое свечение.
В чистом кислороде горение происходит при 400…500°С.
С серой титан реагирует только при высокой температуре (~tпл.), образуя сульфиды.
При высокой температуре титан проявляет исключительную способность реагировать с азотом:
toC
2Ti + N2 = 2TiN – нитрид титана (с металлами образует твёр-
дые растворы).
Титан обладает интересным свойством поглощать значительное количество водорода (1 моль титана поглощает 2 моля водорода). С ростом температуры растворимость водорода уменьшается.
С углеродом титан образует карбид титана.
Титан стоек к азотной, серной кислотам, «царской водке» и другим кислотам вследствие образования пассивной оксидной плёнки (если её удалить – начнётся реакция).
Применение в технике. Благодаря очень высокой коррозионной стойкости, титан - прекрасный материал для химической промышленности. Главное свойство титана – высокие прочность и жаростойкость, а также коррозионная стойкость чистого титана и его сплавов делает его очень ценным материалом для авиа – и ракетостроения, в ядерной технике и др. (Например, пластина из титана 10 лет пробыла в морской воде – и ни следа коррозии. Такая же пластина из железа за это время полностью растворилась).
Титан лишь немного тяжелее алюминия, но зато в 6 раз прочнее его и сохраняет прочность с легирующими добавками до 500…650 °С, а алюминий – лишь до 300 °С. При использовании титана в двигателях внутреннего сгорания их массу можно снизить на 30 %. Титан в 12 раз тверже алюминия, в 4 раза – железа и меди, по прочности превосходит многие стали. Предел текучести у титана в 13 раз больше, чем у алюминия. Титан обладает значительным электрическим сопротивлением. (Если условно принять электропроводность серебра за 100, то этот показатель у меди будет 94, алюминия – 60, железа – 15, а у титана – всего 4.)
Титан в виде сплавов с железом (ферротитан) применяется в качестве добавки при производстве специальных сталей. Достаточно прибавить к стали всего лишь одну тысячную долю титана, чтобы резко улучшить её качество.
234
Интересно свойство нитинола (сплав: никель + титан) «запоминать» ранее приданную форму. Если из листа этого сплава изготовить деталь сложной конфигурации, выдержать ее под нагрузкой при 350 °С, охладить и затем деформировать (например, смять), то после повторного нагревания первоначальная форма детали восстанавливается.
Из карбидов титана и ванадия с добавкой меди получают сплавы, по твердости приближающиеся к алмазу. Учитывая распространенность титана в природе, можно считать, что это – материал буду-
щего.
Важнейшие соединения титана:
1.Диоксид титана (ТiО2) – применяется для изготовления тугоплавких стекол, глазури, эмали, для приготовления белой краски (титановые белила).
2.Титанат бария (ВаТiО3) – имеет высокую диэлектрическую проницаемость. Его кристаллы применяются в электрических конденсаторах высокой емкости и малых размеров, в ультразвуковой аппаратуре, в гидроакустических устройствах и т.д. Этот материал обладает способностью деформироваться под действием электрического поля – пьезоэлектрик.
15.2.Железо.
Железо относится к VIII-В группе периодической системы. Это серебристо-белый металл, обладает хорошей ковкостью, пластичностью и сильными магнитными свойствами. Плотность 7,87 г/см3, температура плавления 1539 °С, температура кипения 2750 °С.
Характеризуется наличием ряда полиморфных изменений: Альфа-Fe – при 768 °С теряет магнитные свойства и переходит в
бета-Fe.
Гамма-Fe – существует при 1401°С и дельта-Fe – при температуре более 1401 °С и при 1539 °С плавится.
Нахождение в природе и получение. Железо относится к ме-
таллам, известным человечеству с глубокой древности. Еще в Древнем Египте из него изготавливали различную домашнюю утварь.
Железо – второй после алюминия по распространенности элемент в природе – оно составляет 5,1% земной коры. В свободном со-
стоянии железо встречается только в метеоритах. Важнейшие руды:
-магнитный железняк – Fe3O4 (FeO·Fe2O3);
-красный железняк – Fe2O3;
-бурый железняк – Fe2O3·Н2О;
235
-шпатовый железняк – FeCO3;
-железный колчедан FeS2 (пирит) – используют не для получения чугуна (много серы), а для получения серной кислоты.
В промышленности железо получают восстановлением его углеродом (коксом) и оксидом углерода II в доменных печах.
Доменный процесс – это восстановительный процесс, в результате которого из природных кислородных соединений железо восстанавливается, освобождается от вредных примесей (S, P) и соединяется
сизбытком углерода (чугуны).
Химизм доменного процесса следующий:
toC |
|
|
|
C + O2 = CO2 ; |
|
|
|
toC |
|
|
|
CO2 + C = 2CO ; |
|
|
|
450−500O C |
+ CO2 ; |
||
3Fe2O3 + CO |
= |
2Fe3O4 |
|
600O C |
|
|
|
Fe3O4 + CO = |
3FeO + CO2 ; |
||
700O C |
Fe + CO2 . |
|
|
FeO + CO = |
|
||
Чугун содержит 92…95 % Fe+2,14…6,67 %С+0,5…2 %Si + (иногда) до 2 % Р и других элементов. Чугун выпускается:
–передельный – идет на изготовление сталей (в нем много С, Mn, Si и др.).
–литейный – идет на изготовление изделий машиностроения (станины, корпуса, детали машин и др.).
В зависимости от состояния углерода в сплаве чугуны бывают: а) белые – углерод содержится в виде цементита (карбида желе-
за) Fe3C (очень твердые и хрупкие).
б) серые – углерод находится в виде графита. При длительном нагревании карбид железа разлагается:
Fe3C→3Fe+C (превращение белого чугуна в серый). Сталь получают из чугуна различными способами:
1)Конверторный – продувка чугуна воздухом или кислородом в конверторах с различной футеровкой (процесс Бессемера).
2)Мартеновский – проводят в печах Мартена регенеративного типа с кислой или основной футеровкой подины. Ускорение процесса достигается кислородным дутьём.
236

Сущность сталеплавильного процесса – окисление примесей в чугуне и удаление их в виде шлака, а также снижение содержания углерода:
Si+O2=SiO2 2Mn+O2=2MnO
2Fe3C+O2=6Fe+2CO↑ («кипение» стали).
3)Электроплавка – осуществляют в индукционных дуговых печах – для переплавки мартеновской или конверторной стали с целью улучшения ее качества.
4)Бездоменный процесс – позволяет перерабатывать бедные руды при значительной экономии кокса. В этом случае получают не чугун, а железо, спечённое в куски.
5)Раньше применяли кричный метод – получение стали в домницах (с древесным углем) при температуре ниже температуры плавления железа, а затем – специальная проковка. Получалось чистое железо, т.к. в твердом состоянии почти не насыщалось примесями (сталь знаменитой марки «Черный соболь» на Демидовских заводах).
Химические свойства. Железо относится к VIII-В группе периодической системы. Его электронно-графическая формула:
3d |
4s 4p |
+E |
3d |
4s 4p |
Fe |
возбуждение Fe* |
невозбужденное |
возбужденное |
состояние |
состояние |
Валентные электроны у атома железа находятся на последнем электронном уровне (4s2) и предпоследнем (3d6).
В химических реакциях железо может отдавать эти электроны и проявлять валентность II, III и иногда VI.
Fe0 – 2ē=Fe2+ ; Fe0 – 3ē=Fe3+
В реакциях железо является восстановителем. Однако при обычной температуре оно не взаимодействует даже с самыми активными окислителями (галогенами, кислородом, серой), хотя при нагревании становится активным и реагирует с ними:
toC
Fe + Cl2 = FeCl2 ;
237
toC |
|
Fe + S = FeS ; |
|
t oC |
|
3Fe + 2O2 = Fe3O4 (FeO × Fe2O3 |
- оксид железа II, III ). |
В мелкораздробленном состоянии (размер частиц менее 5 мкм) железо самовоспламеняется на воздухе, т.е. обладает пирофорными свойствами.
При очень высокой температуре железо реагирует с углеродом, кремнием и фосфором:
toC
3Fe + C = Fe3C – карбид железа (цементит);
toC
3Fe + Si = Fe3Si – силицид железа;
toC
3Fe + 2P = Fe3 P2 – фосфид железа (II).
Во влажном воздухе железо быстро окисляется (корродирует):
4Fe+3O2+6H2O=4Fe(OH)3;
Fe(OH )3 → FeO(OH ) + H2O – оксид – гидроксид железа.
Железо находится в середине ряда напряжений, поэтому является металлом средней активности. Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и алюминия. Только при высокой температуре раскаленное железо реагирует с водой:
500−700O C |
|
||
3Fe + 4H2O |
= |
Fe3O4 |
+ 4H2 - |
Железо реагирует с разбавленными серной и соляной кислотами, вытесняя из них водород:
Fe+2HCl(р)=FeCl2+H2↑; Fe+H2SO4(р)=FeSO4+H2↑.
При обычной температуре железо не взаимодействует с концентрированной H2SO4, т.к. пассивируется ею. При нагревании концентрированная H2SO4 окисляет железо до сульфата железа (III):
tO C
2Fe + 6H2SO4(К ) = Fe2 (SO4 )3 + 3SO2 + 6H2O .
Разбавленная азотная кислота окисляет железо до нитрата желе-
за (III):
238
Fe+4HNO3(р)=Fe(NO3)3+NO↑+2H2O.
Концентрированная HNO3 пассивирует железо.
Из растворов солей железо вытесняет металлы, стоящие после него в ряду напряжений:
Fe+CuSO4=FeSO4+Cu; (Fe0+Cu2+=Fe2++Cu0).
Применение в технике. Железо – основной конструкционный материал в технике.
а) Углеродистые стали – широко используют в машиностроении, на транспорте, в строительстве.
б) Упрочненные низколегированные стали (содержат до 1-2%
хрома, марганца, никеля, кремния) – применяют для снижения веса конструкций.
в) Специальные стали с определенными свойствами (прочность,
пластичность, жаропрочность, коррозионная стойкость) содержат большие количества легирующих компонентов:
-стали с высокой твердостью: ШХ15 (хрома 1,5%), Р18М (18%W, 4%Cr, 1%Mo, 1%V и т.д.);
-нержавеющие стали – 08Х18Н10Т, 30Х24Г12. Эти стали очень стойкие в различных агрессивных средах.
г) Металлокерамические изделия (используются железные по-
рошки. Применяют, например, в подшипниках скольжения).
д) Сплавы на основе железа:
-пермаллой – сплав 22% Fe + 78% Ni – обладает интенсивной намагничиваемостью даже в слабых полях.
-инвар – сплав 64% Fe + 36% Ni – практически не расширяется при нагревании до 100°С и применяется в электрорадиотехнике и химическом машиностроении.
Важнейшие соединения железа:
Соединения железа (II) – отвечают оксиду железа (II) – FeО:
-сульфат железа FeSO4·7H2O – железный купорос. Применяют для борьбы с вредителями растений, в производстве чернил и минеральных красок, при крашении тканей.
Ввиду способности легко окисляться, соли железа (II) часто применяют как восстановители.
Соединения железа (III) – отвечают оксиду железа (III) – Fe2O3.
-хлорид железа (III) – FeCl3 – темно-коричневые кристаллы. Применяют в качестве коагулянта при очистке воды, как катализатор в органическом синтезе и др.
239
-сульфат железа (III) - Fe2(SO4)3·9H2O – желтые кристаллы. Применяют для травления металлов, для очистки воды и др.
-оксид железа Fe2O3 – применяется как коричневая краска – железный сурик.
-ферриты – соли не полученной в свободном виде железистой
кислоты HFeO2:
Fe2O3+Na2CO3=2NaFeO2+CO2↑.
В технике ферриты – это продукты спекания Fe2O3 с оксидами двухвалентных металлов (Ni, Mn, Zn и т.д.) при 1000…1400°С.
Ферриты обладают ценными магнитными свойствами и высоким электрическим сопротивлением, что обусловливает небольшие электрические потери в них:
-берлинская лазурь – Fe4[Fe(CN)6]3 – применяется как синяя краска.
-красная кровяная соль – K3[Fe(CN)6] – красная краска.
15.3 Медь
Чистая медь – тягучий вязкий металл светло-розового цвета, легко прокатывается в тонкие листы. Очень хорошо проводит тепло и электрический ток.
Плотность ρ = 8,96 г/см3; tпл.=1083 °С, tкип.=2740 °С.
Нахождение в природе и получение. Общее содержание меди в земной коре сравнительно невелико (0,01%).
Важнейшие минералы:
-медный блеск (халькозин) – Cu2S;
-медный колчедан (халькопирит) – CuFeS2;
-малахит (CuOH)2CO3.
Так как медь – слабый восстановитель, то она встречается в природе в самородном состоянии, хотя и редко.
Процесс получения меди из сульфидных руд слагается из следующих операций:
1. Обжиг. При обжиге большая часть сульфидных примесных элементов превращается в оксиды:
4CuFeS2+13O2=4CuO+2Fe2O3+8SO2.
2. Плавка. При плавке на штейн образующиеся оксиды Fe, Zn и др. отделяются в виде шлака. При этом для образования шлака прибавляются кокс и песок:
2CuO+FeS+C+SiO2=Cu2S+FeSiO3+CO.
240
