
химия + методичка / theory
.pdf
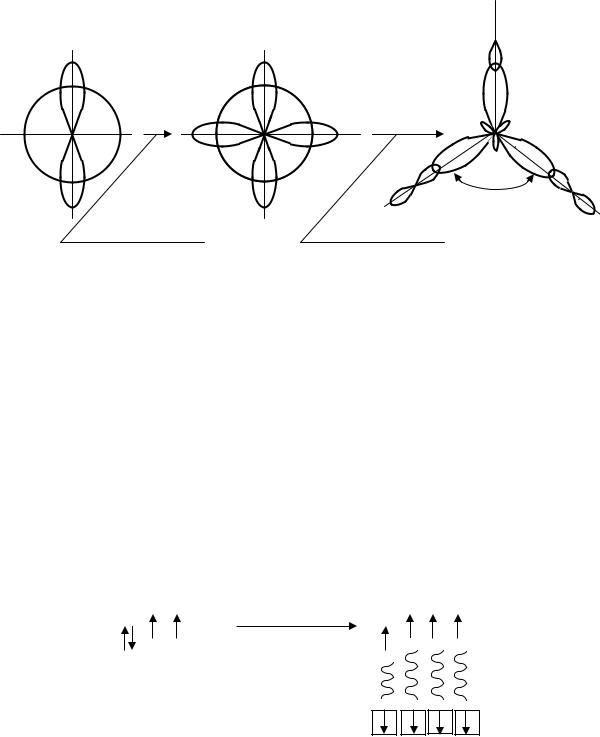
ны на расстоянии 0,53Å от ядра, то, если электронные облака не проникают друг в друга, длина связи должна быть равна: r0=0,53·2=1,06 Å
H |
H |
– |
– |
+ |
+ |
Силы притяжения. Силы отталкивания.
E |
Энергия отталкивания |
|
r0
Результирующая кривая
r
Eсв 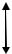
A
 Энергия притяжения
Энергия притяжения
Рис. 4.1. Кривая потенциальной энергии для молекулы водорода.
В действительности же r0=0,74Å, значит, происходит перекрывание электронных облаков и образование двуэлектронного молекулярного облака с повышенной плотностью между ядрами (рис. 4.2).
41
|
r=0,53Å |
|
|
|
|
z |
|
z |
z |
|
z |
z |
z |
|
|
+ |
x |
x |
+ |
+ |
x x |
+ |
x |
+ |
|
+ |
|
||||
y |
y |
|
y |
y |
y |
y |
Å |
|
|
|
|
1,06 Å |
|
0,74 |
|
|
|
|
|
|
|
|
|
|
Рис. 4.2. Схема образования связи в молекуле водорода. |
|
|
||||
Согласно теории валентных связей (Л. Полинг, США) в зависимости от характера распределения электронной плотности в молекуле различают следующие виды химических связей:
1.Ковалентную (полярную и неполярную) с разновидностями: а) ионная; б) донорно-акцепторная; в) дативная;
2.Водородную;
3.Металлическую;
4.Ван-дер-Ваальсову связь (межмолекулярное взаимодействие).
4.3. Ковалентная связь
Ковалентная связь между атомами возникает в результате «спаривания» электронов, которое возможно лишь тогда, когда спины электронов соединяющихся атомов противоположны. За счет взаимодействия магнитных полей этих электронов атомы «стягиваются» в молекулу, образуя пару «обобществленных» электронов (свя-
зующее электронное облако).
То есть ковалентная связь образуется парой электронов, обобществляемых между двумя соседними атомами. Каждый из этих атомов поставляет на образование ковалентной связи по одному электрону:
A 

 +
+ 

 B → A
B → A 

 B
B
При образовании устойчивых молекул каждый атом достигает электронной конфигурации инертного элемента – S2P6 (правило «октета»).
Ковалентная связь между двумя атомами может возникнуть за счет образования не только одной, но и двух, и трех электронных пар. Рассмотрим образование ковалентной связи в молекуле Cl2.
42
Электронная формула внешнего уровня атома хлора 3S23P5, элек- тронно-графическая формула:
|
3s |
3p |
|
Общая электронная пара |
|||||
|
|
|
|
|
3s23p6 |
|
|
||
|
|
|
|
|
|
||||
Cl |
|
|
|
|
|
|
3p |
3s |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||
3p |
Cl |
Cl |
3s |
|
|
|
3s23p6 |
|
|
Cl |
|
|
|
Один из р-электронов в атоме хлора является неспаренным. При образовании молекулы неспаренные электроны двух атомов хлора образуют одну общую электронную пару; в результате каждый атом хлора приобретает устойчивую электронную конфигурацию 3s23p6. Перекрывание электронных облаков в молекуле хлора показано на рис. 4.3.
z |
|
z |
|
z |
z |
|
+ |
x + |
+ |
x |
+ |
+ |
x |
y |
|
y |
|
y |
y |
|
Рис. 4.3. Схема перекрывания электронных облаков в молекуле хлора.
Или: Cl–Cl, или: Cl:Cl
Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется одинарной (про-
стой) связью.
При образовании молекулы кислорода образуется две общих электронных пары, а при образовании молекулы азота – три.
Молекула кислорода:
8O…2s22p4
|
2s |
2p |
|
|
|
|
|
|
|
Общие электронные пары |
||||||||||
8O |
|
|
|
|
|
|
|
|
|
8O |
2s22p6 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O8 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
O8 |
или: O=О |
|
|
|
2s22p6 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
2p |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
О::О |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2s |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
43 |
|
|
|
|
|
|
|
|
|

Молекула азота: |
|
|
7N…2s22p3 |
|
|
2s |
2p |
Общие электронные пары |
|
2s22p6 |
|
7N |
|
|
|
7N |
N7 |
|
|
|
|
N7 |
или: N≡N |
2s22p6 |
|
|
|
|
|||
|
2p |
|
||||
|
|
|
||||
|
2s |
|
||||
|
|
|
N:::N |
|
||
При этом также, как и в молекуле хлора, в молекулах кислорода и азота оба атома приобретают электронную конфигурацию инертного элемента (с учетом общих электронных пар). Такие связи называют кратными (в молекуле кислорода – двойная, в молекуле азота –
тройная).
Ковалентная связь тем более прочна:
-чем больше перекрывание электронных облаков;
-чем выше плотность связующего электронного облака. Степень перекрывания электронных облаков зависит от их раз-
мера, формы и способа перекрывания.
4.3.1. Гибридизация электронных облаков (Л.Полинг, 1931г.)
Образование связей может происходить за счет орбиталей разной конфигурации одного атома, в основном, s- и p-орбиталей (эти орбитали разные по энергии, значит, и образуемые ими связи также должны быть разные по энергии, т.е. отличаются по прочности).
Чаще всего это происходит у атомов в возбужденном состоянии.
При этом до образования связей происходит гибридизация электронных облаков, т.е. комбинирование s- и р-орбиталей так, что энергия их выравнивается, формы изменяются и образуются равноценные (равнопрочные) гибридные орбитали.
Это приводит к одинаковой прочности образующихся потом связей.
Основные типы гибридизации: sp, sp2 и sp3.
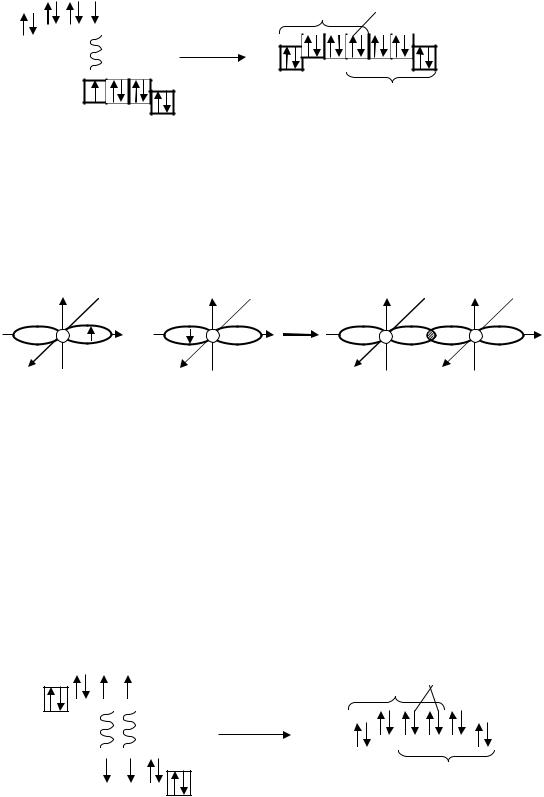
sp-гибридизация: Рассмотрим этот тип гибридизации на примере молекулы хлорида бериллия BeCl2. В основном (невозбуждённом) состоянии атом бериллия «нульвалентен», в возбужденном состоянии валентность бериллия в этом соединении равна двум. Этот тип гибридизации характерен для двухвалентных атомов (линейные молекулы).
44
В результате гибридизации одной 2s-орбитали и одной 2p-орбитали образуются две гибридные орбитали («неравнобокие гантели»), одинаковые по форме и энергии. Эти гибридные орбитали расположены под углом 180º. sp-гибридные орбитали атома бериллия перекрываются с p–орбиталями двух атомов хлора с образованием двух равнопрочных связей.
|
2s |
|
2p |
Возбуждение |
2s |
|
2p |
||
|
|
|
|
|
|
|
|||
4Be |
|
|
|
|
+Е |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl 



 Cl
Cl
Cl |
Be |
Cl |
180º
Be…2s2 Be…2s12p1
Возбуждение (+E) |
Гибридизация |
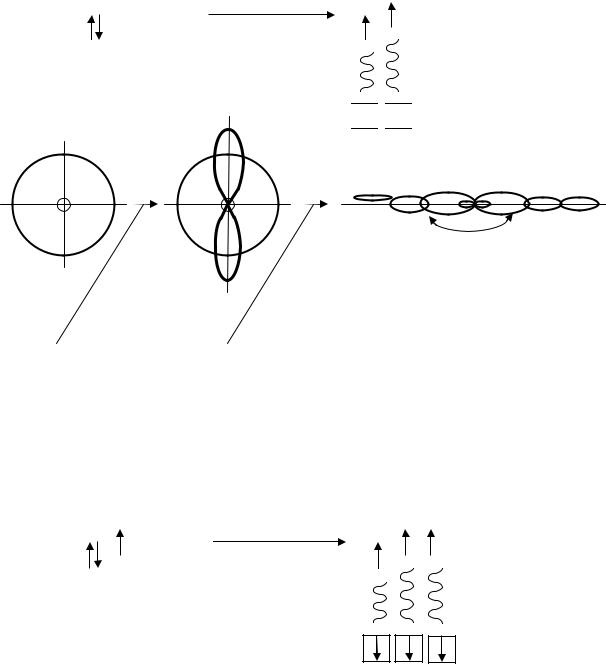
sp2 – гибридизация: Рассмотрим этот тип гибридизации на примере молекулы хлорида бора BCl3. Валентность бора в возбуждённом состоянии равна трём:
|
|
2s |
2p |
Возбуждение |
2s |
2p |
|||
|
|
|
|
|
|
|
|
|
|
5B |
|
|
|
|
+Е |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl Cl Cl
45
Cl 
|
|
|
B |
|
B…2s1p2 |
Cl |
Cl |
B…2s2p1 |
|
||
|
120º |
||
|
|
|
|
|
Возбуждение (+Е) |
Гибридизация |
|
В результате гибридизации одной 2s-орбитали и двух 2pорбиталей образуются три гибридные орбитали, которые располагаются в одной плоскости; угол между орбиталями 120º.
Гибридные sp2-орбитали атома бора перекрываются с p- орбиталями трёх атомов хлора с образованием трёх равнопрочных связей.
Этот тип гибридизации характерен для трёхвалентных атомов. Молекулы с sp2-гибридизацией (в данном случае BCl3) имеют форму равностороннего треугольника.
sp3-гибридизация: В состоянии sp3-гибридизации находится, например, атом углерода в молекуле тетрахлорида углерода CСl4. В этом состоянии атом углерода образует 4 одинарные связи, т.е. его валентность равна четырём.
|
2s |
2p |
|
2s |
2p |
||||
|
|
|
|
|
Возбуждение |
|
|
|
|
|
|
|
|
|
|
|
|
||
6С |
|
|
|
|
+Е |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Сl Сl Сl Сl
Из четырёх неспаренных электронов три p-электрона имеют одну энергию, а один s-электрон – другую. Связи были бы неравнопрочны и молекула – неустойчивой.
В результате гибридизации одной 2s-орбитали и трёх 2pорбиталей образуются четыре гибридные орбитали, равные по энергии и расположенные под углом 109º28’ друг к другу.
46

|
Возбуждение (+Е) |
Гибридизация |
|
|
Cl |
|
|
109º28’ |
|
|
C |
|
|
Cl |
C…2s22p2 |
C…2s12p3 |
Cl |
|
|
Cl |
Этот тип гибридизации характерен для четырёхвалентных атомов (тетраэдрические молекулы).
Наиболее распространённые геометрические формы различного типа представлены в таблице 4.1.
|
|
Таблица 4.1 |
|
Пространственное строение молекул различного типа |
|||
|
|
|
|
Тип молекулы |
Пространственное строение |
Примеры молекул |
|
AB2 |
Угловое |
H2O, H2S, OF2 |
|
|
Линейное |
BeCl2, MgBr2, CO2 |
|
AB3 |
Пирамидальное |
NH3, PCl3, AsH3 |
|
|
Треугольное |
BCl3, AlBr3 |
|
AB4 |
Тетраэдрическое |
CH4, CCl4, SiH4 |
|
4.3.2. Свойства ковалентной связи
Важнейшими характеристиками ковалентной связи являются:
1)Длина связи (r0, Å, нм) – это среднее расстояние между ядрами соединяющихся атомов.
Например: H–H (r0= 0,74Å или 0,074 нм) O–H (r0=0,97Å или 0,097 нм)
O–O (r0=1,48Å или 0,148 нм) и т.д.
2)Энергия связи (Eсв., кДж/моль) – это энергия, необходимая для
разрыва связи. Она характеризует прочность связи (чем больше Eсв., тем выше прочность связи).
3) Кратность связи – это число общих электронных пар, ответственных за возникновение связи.
Молекула Cl2: Cl−Cl – кратность связи равна 1.
47
Молекула O2: O=O – кратность связи равна 2. Молекула N2: N≡N – кратность связи равна 3.
4)Насыщаемость. Атом не может принять других атомов больше, чем он имеет холостых электронов. Например, молекула ме-
тана CH4. В ней насыщены все четыре валентности углерода и валентности четырёх атомов водорода(см.выше).Поэтому существование соединения , например, формулы CH5 в принципе невозможно.
5)Ковалентность. Общее число связей, в которых участвует данный атом, может быть больше числа неспаренных электронов. Поэтому наряду с понятием «валентность» атома иногда пользуются понятием «ковалентность».
Ковалентность атома определяется числом всех его орбиталей, участвующих в образовании связей – как занятых неспаренными электронами, так и свободных (см. ниже «донорно-акцепторная» связь.) Например, Бериллий:
2s 2p
4Be*
валентность равна 2. ковалентность равна 4.
6) Направленность. Ковалентным связям присуще определённое пространственное направление относительно друг друга.
Ковалентная связь возникает в направлении, в котором достигается максимальное перекрывание орбиталей взаимодействующих атомов.
По пространственному расположению различают три типа ковалентной связи:
а) сигма-связь (σ-связь) – это связь, имеющая ось симметрии. Она располагается вдоль линии, соединяющей центры ядер.
s-s |
s-p |
p-p |
p-d |
d-d |
Одинарные связи всегда являются σ-связями:
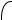 σ-связь
σ-связь
Cl – Cl
48
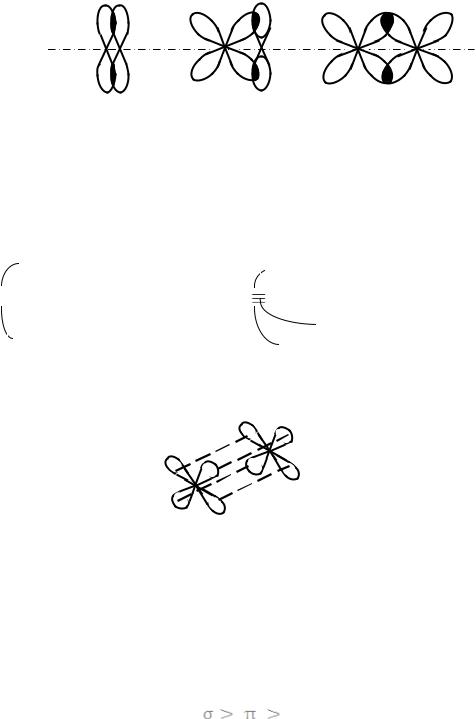
б) Пи-связь (π-связь) – эта связь образуется за счёт перекрывания p- и d-орбиталей по обе стороны от линии, соединяющей центры ядер атомов, т.е. эта связь, характеризуется плоскостью симметрии:
p-p |
d-p |
|
d-d |
|
|||
|
|||
|
π-связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары.
Любая двойная связь состоит из одной σ-связи и одной π-связи. Тройная связь состоит из одной σ-связи и двух π-связей.
|
|
σ-связь |
|
|
|
|
|||
|
|
|
π-связь |
|
|
||||
O = O |
N |
||||||||
N |
|
|
|||||||
|
|
|
|
|
|
σ -связь |
|
||
|
π-связь |
|
|||||||
|
|
|
|
|
|
||||
|
|
|
π-связь |
|
|||||
|
|
|
|
||||||
в) Дельта – связь (δ-связь) – эта связь образуется d-орбиталями |
|||||||||
при одновременном перекрывании всех четырёх лепестков: |
|||||||||
Степень перекрывания электронных облаков при образовании π- связи меньше, чем при образовании σ-связи, поэтому прочность π- связей меньше ,чем σ-связей (примерно в 1,5 раза).
Следовательно, при химических взаимодействиях с участием атомов с кратными связями, первой разрывается π-связь, как менее прочная. Таким образом, прочность связей убывает в последовательности:

 .
.
7) Поляризуемость связи.
При соединении двух атомов, имеющих одинаковые значения электроотрицательности (ЭО), связующее электронное облако находится посередине межъядерной оси, т.е. не смещено ни к одному ато-
49

му. Такая связь называется ковалентной неполярной связью. (Разность ЭО=0, например, молекула H2).
При соединении же атомов, имеющих различные значения ЭО, связывающие электронное облако поляризуется, т.е. смещается в сторону того атома, ЭО которого выше. Образующаяся при этом связь называется ковалентной полярной связью.
Например, в молекуле хлорида водорода HCl связующее электронное облако смещено к ядру хлора. (ЭОH=2,1; ЭОCl=3,0). В результате на атоме хлора возникает некоторый отрицательный заряд (-δ), а на атоме водорода – равный по величине положительный заряд (+δ) .
Количественно полярная связь характеризуется дипольным моментом(μ):
μ = δ ×l ,
где δ – эффективный заряд; l – расстояние между зарядами. Единица измерения дипольного момента – Дебай (Д).
1Д = 0,33·10-29 Кл·м. Дипольный момент – величина векторная, его изображают стрелкой.
4.4. Ионная связь
Предельным случаем поляризации ковалентной связи является
ионная связь, которая сопровождается практически полным смещением связующего электронного облака к более электроотрицательному атому с последующим электростатическим притяжением образовавшихся разноимённо заряженных ионов.
Как мы уже знаем, наименьшую ЭО имеют типичные металлы, атомы которых наиболее легко отдают электроны, а наибольшую ЭО имеют типичные неметаллы, атомы которых легко присоединяют электроны. Поэтому ионная связь образуется между атомами типичных металлов и типичных неметаллов.
При отдаче электронов атомы металлов превращаются в положительно заряженные ионы (катионы), а атомы неметаллов превращаются в отрицательно заряженные ионы (анионы).
При этом каждый из ионов приобретает устойчивую структуру инертного элемента (s2p6). Например, NaCl:
2s22p63s1 |
|
2s22p6 |
|
Na |
– |
ē |
Na+ |
3s23p5 |
|
3s23p6 |
|
Cl |
+ |
ē |
Cl– |
|
|
|
50 |
