
химия + методичка / theory
.pdf
а) Жидкостная коррозия – это коррозия металлов в жидких не-
электролитах – нефть и продукты её переработки (бензин, керосин, смазочные масла и т.д.), органические растворители и т.д.
Например, в нефти может содержаться до 5% серы и других серусодержащих продуктов. Определённая часть этих продуктов попадает в моторное топливо. В цилиндре двигателя при высокой температуре эти вещества (например, сера) взаимодействуют с кислородом и парами воды (H2O+O2) c образованием серной кислоты H2SO4, которая разрушает стенки цилиндров двигателя. Во многом качество моторного топлива определяется содержанием в нём серусодержащих веществ.
б) Газовая коррозия – это коррозия металлов в газовых средах при повышенных температурах, исключающих конденсацию влаги (топочные газы, галогены, H2S, SO2, CO2 и др.)
Практически наиболее важный – это процесс окисления металлов кислородом ( t > 300°C). Так , железо в атмосфере топочных газов образует смесь оксидов (окалину):
Fe + 1 O = FeO |
ü |
|
||
2 |
2 |
|
ï |
|
|
|
ï |
|
|
2Fe +1,5O2 |
|
окалина |
||
= Fe2O3 ý |
||||
3Fe + 2O = Fe O |
ï |
|
||
|
2 |
3 4 |
ï |
|
(FeO × Fe2O3 ) |
ï |
|
||
þ |
|
|||
Механизм газовой коррозии сводится к диффузии газов через плёнку корродированного металла внутрь него и встречной диффузии катионов металла.
δ |
δ |
Рис. 11.1. Схема роста оксидного слоя на поверхности металла.
181
а) Преимущественная диффузия ионов О2-. Толщина коррози-
онного образца (δ) не меняется (утолщение плёнки происходит за счёт уменьшения толщины металла)
б) Преимущественная диффузия катионов Меn+. Толщина корродирующего образца растёт.
Газовой коррозии подвергаются электронагревательные устройства, лопатки турбин, котельные установки, арматура топок и печей и др. Некоторые металлы, покрываясь при невысоких температурах оксидными плёнками, способны противостоять газовой коррозии. Так, плёнки на алюминии (Al2O3), хроме (Cr2O3) и др. – весьма прочны и жаростойки.
11.2.2. Электрохимическая коррозия
Это наиболее распространённый тип коррозии ( 80% всех разрушений).
Эта коррозия протекает в средах, проводящих электрический ток (растворы кислот, солей, оснований, морская и речная вода, грунтовые воды, атмосферная влага и др.) Электрохимическая кор-
розия разделяется на следующие виды – гальванокоррозию и электрокоррозию:
I. Гальванокоррозия. При гальванокоррозии имеют место процессы, сходные с теми, которые протекают при работе гальванического элемента.
Так же, как и для работы гальванического элемента, для гальванокоррозии необходимо наличие двух разных электродов и раствора электролита.
Поэтому чистые металлы электрохимической коррозии не подвергаются. Гальванокоррозия, в свою очередь, имеет следующие разновидности:
а) Макрогальванокоррозия (контактная) – возникает при контакте различных металлов.
Поместим пластинку из чистого цинка в раствор HCl. Выделения водорода практически нет. Реакция не идёт потому, что ионы Zn2+, начинающие переходить в раствор, создают у поверхности пластинки своеобразный барьер, который препятствует ионам Н+ подходить вплотную к цинковой пластинке, принимать от неё электроны и восстанавливаться.
182
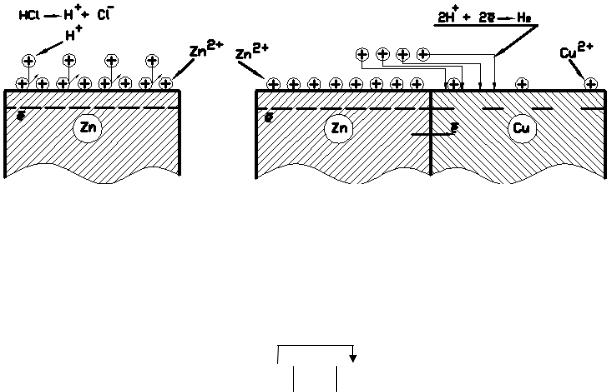
Цинк, не отдавая электроны, прекращает растворение. Однако, если прикоснутся к этой пластинке менее активным металлом (например, медью), то образуется гальваническая пара и начинается энергичное выделение водорода на поверхности меди и растворение цинка.
ē
(−)Zn HCl Cu(+)
В возникшем гальваническом элементе электроны цинка переходят к меди и ликвидируют защитный барьер из её ионов
(Сu2+ + 2e = Cu0 ). Таким образом, создаются необходимые условия для беспрепятственного восстановления ионов водорода
( 2H + + 2e = H2 − ).
При этом, как в обычных гальванических элементах, разрушается (растворяется), отдавая электроны, более активный металл – цинк.
Участок металлической поверхности, с которого ионы переходят в раствор, т.е. участок, где металл растворяется (корродирует),
является анодным участком.
Участок, на котором разряжаются катионы электролита, называется катодным участком.
Характер катодных процессов при коррозии определяется веществами, имеющимися в растворе:
1. В сильнокислой среде (рН < 7) восстанавливаются ионы водорода Н+ кислоты (коррозия с водородной деполяризацией). Например:
183

ē
(−)Fe | H2SO4 | Cu(+)
↓
2H + + SO42−
( E0 |
2+ = −0,44B − анод, E0 |
2+ = 0,34B − катод) |
Fe / Fe |
Cu / Cu |
|
(−)А: Fe0 − 2e = Fe2+ (+)K : 2H + + 2e = H2 −
Вторичный процесс: Fe2+ + SO42− = FeSO4 ↓ – продукт коррозии. 2. В нейтральной (вода + О2) и щелочных средах (pH ≥ 7) на ка-
тоде восстанавливается растворённый в воде кислород (коррозия с ки-
слородной деполяризацией):
ē
(−)Fe H2O + O2 Cu(+)
(−)A : Fe0 − 2e = Fe2+
(+)K : 2H2O + O2 + 4e = 4OH −
Вторичный процесс: Fe2+ + 2OH − = Fe(OH)2 – жёлтая гелеобразная ржавчина, которая тут же окисляется:
2Fe(OH)2 + 12 O2 = 2FeO(OH) + H2O – рыхлая бурая ржавчина (оксид – гидроксид железа).
б) Микрогальванокоррозия.
Возникает чаще всего из-за химической неоднородности металла. В технических металлах, содержащих примеси, образуется множество микрогальванических пар, в которых анодом, как правило, является основной металл (он и разрушается), а катодом – частицы примесей. Т.к. размер примесей очень мал, этот вид коррозии и называется микрогальванокоррозией. Например, техническое железо (сталь) содержит примеси цементита (карбид железа) Fe3C. Около каждой частицы Fe3C образуется микрогальванопара:
184
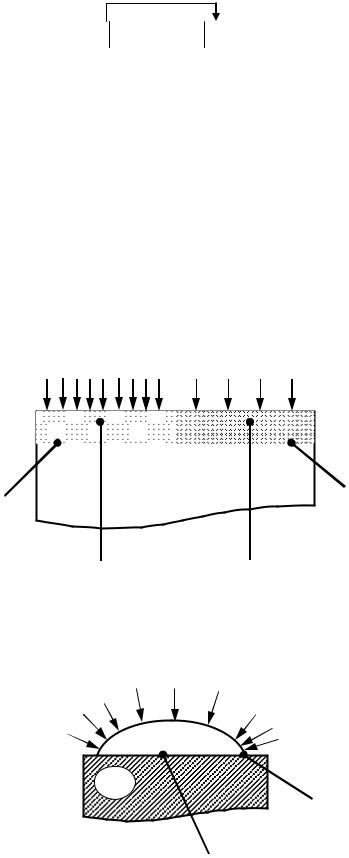
ē
(−)Fe H2O + O2 Fe3C(+)
(−)A : Fe0 − 2e = Fe2+
(+)K : 2H2O + O2 + 4e = 4OH −
с) Коррозия, появляющаяся из-за различного доступа кислорода к металлической поверхности.
Например, одна часть металлической поверхности покрыта глиной, а другая – песком. Т.к. проницаемость кислорода через слой глины меньше, чем песка, на металлической поверхности возникает концентрационный гальванический элемент (см. выше), где участок под глиной будет (-) Анодом (так как концентрация кислорода здесь меньше), а под песком – (+) Катодом. Напомним, что в концентрационных гальванических элементах анодом является электрод с меньшей концентрацией электролита.
O2 |
O2 |
||
|
|
|
|
|
|
|
|
( + ) К |
( – ) А |
Песок Глина
Концентрационный гальванический элемент возникает и на по-
верхности металла под слоем обычной дождевой капли:
|
O2 |
O2 |
O2 |
|
Fe
К(+)
А(–)
185
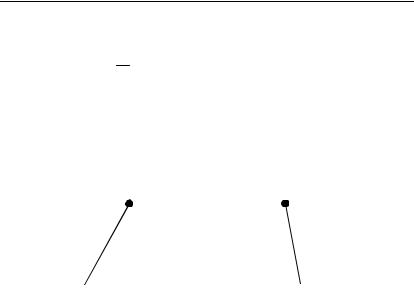
На поверхности металла под центром капли концентрация кислорода меньше (т.к. толщина слоя воды больше), значит, это анод-
ный участок, а на периферии капли – катодный участок (там кон-
центрация кислорода больше). В обоих рассмотренных случаях возникают процессы:
(−)A: Fe0 − 2e− = Fe2+ − железо разрушается
(+)K : 2H2O + O2 + 4e− = 4OH −
Fe2+ + 2OH − = Fe(OH )2
2Fe(OH)2 + 12 O2 = 2FeO(OH ) + H2O
д) Коррозия, появляющаяся из-за различной температуры на поверхности металла (t<100°C).
T1 |
T2 |
T1 |
< T2 |
|
т.е. |
||||
|
|
|||
|
|
E1 |
< E2 |
|
(-)A |
(+)K |
|
|
|
е) Коррозия, появляющаяся из-за наличия неравномерной плёнки (например, оксидной), смазки, пыли на поверхности металла.
II. Электрокоррозия. Это коррозия под действием «блуждающих» токов. Электрокоррозии подвергаются подземные сооружения, трубопроводы и др. Источники «блуждающих» токов – линии электропередач, выпрямители, электрифицированный транспорт и др. Иногда сила «блуждающего» тока достигает 300А (а 1А, например, в год разрушает9 кг железа, 11 кг меди, 34 кг свинца – см. формулу (9.4).
В местах выхода попадающего в подземное металлическое сооружение «блуждающего» тока – анодах – наблюдается очень интенсивная коррозия, которая часто приводит к полному разрушению заложенных в землю металлических конструкций:
(−)A: Fe0 − 2e = Fe2+
186
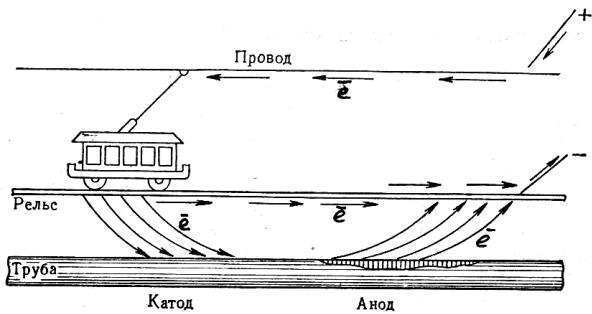
Рис. 11.2. Схема электрокоррозии.
Участки входа «блуждающего» тока в подземные сооружения – катоды, не разрушаются, на них происходит восстановление растворённого в воде кислорода:
(+)K : 2H2O + O2 + 4e = 4OH −
Переменный ток воздействует на коррозию значительно слабее, чем постоянный. Во всяком случае, действие переменного тока находится в зависимости от числа его периодов в секунду.
Борьба с электрокоррозией – поддержание хорошего контакта между рельсами (на стыках) и увеличение сопротивления между рельсами и почвой, а также хорошая электроизоляция подземных сооружений.
Скорость коррозии (ω).
Чаще всего скорость коррозии измеряется толщиной слоя потерянного металла за единицу времени, обычно в мм/год.
ω = |
δ |
, |
мм |
(11.1) |
τ |
год |
По коррозионной стойкости в данной среде металлы классифицируются по группам стойкости (их 6):
1.совершенно стойкие – ω < 0,001 мм/год;
2.весьма стойкие – 0,001< ω <0,05 мм/год;
187
…………………………………………….
5.малостойкие ….1< ω <10 мм/год;
6.нестойкие ……..ω >10 мм/год.
11.3. Методы защиты металлов от коррозии
Главное внимание в борьбе с наиболее распространённым видом коррозии – электрохимической, направляется на то, чтобы исключить возможность образования микро- и макрогальванических элементов.
Рассмотрим основные методы защиты металлов от коррозии: 1. Защитные покрытия. Различают следующие виды покрытий:
А) Неметаллические покрытия:
-краски, лаки, эмали;
-стеклоэмали;
-металлокерамические покрытия;
-покрытия неметаллическими материалами (полимерами).
Б) Химические покрытия. Это искусственно создаваемые на поверхности готовой детали плёнки различного состава, например:
- Оксидирование (создание плёнки Fe3O4 )
3Fe + 8NaNO2 + 4H2O = Fe3O4 + 8NO + 8NaOH .
(FeO×Fe2O3)
-Фосфатирование – создание плёнки Fe3 (PO4 )2 × nH2O .
-Цементация – насыщение поверхностного слоя углеродом в среде оксида углерода СО. При 900°С образуется углерод:
9000 C
2CO → C+ CO2 ,
который диффундирует в металл, образуя карбиды.
- Азотирование – насыщение поверхностного слоя азотом в среде аммиака NH3 при высокой температуре:
6000 C
2NH3 ® 2N + 3H2
Атомарный азот в поверхностном слое детали образует с металлом нитриды ( Fex × Ny ).
- Цианирование – насыщение углеродом и азотом и др.
В) Металлические покрытия. Различают два вида таких покры-
тий:
- Анодное покрытие – это покрытие менее активного металла более активным металлом. В этом случае при нарушении целостно-
188

сти покрытия разрушается металл покрытия, а защищаемый металл остаётся неизменным до тех пор, пока весь металл покрытия не растворится.
Наиболее распространённый тип анодного покрытия – оцинкованное железо (железо покрывается цинком).
H2O+O2
Zn
Fe
При нарушении целостности покрытия в этом месте возникает гальванопара, в которой (-) Анод – цинк, а (+) Катод – железо. Электролит – например, дождевая вода:
ē
(−)Zn H2O + O2 Fe(+)
(−)А: Zn0 − 2e = Zn2+
(+)K : 2H2O + 2e + 4e = 4OH −
å: Zn2+ + 2OH − = Zn(OH)2 ↓ − продукт коррозии .
-Катодное покрытие – это покрытие более активного металла
(например, Fe) менее активным (например, Ni, Sn и др.). В этом случае при нарушении целостности покрытия усиленно корродирует защищаемый металл. Наиболее распространённое катодное покрытие – лужёное железо (железо покрыто оловом).
ē
(−)Fe HCl Sn (+)
(−)A : Fe0 − 2e = Fe2+
(+)K : 2H + + 2e = H2 −
å: Fe2+ + 2Cl− = FeCl2 ↓ −продукт коррозии
189

HCl
Sn
Fe
2. Воздействие на среду с целью снижения её коррозионной активности.
А) Применение ингибиторов – веществ, замедляющих коррозию. Их вводят в коррозионную среду в небольших количествах ( 0,1-0,3% масс.).
Виды ингибиторов:
- Анодные – это вещества, являющиеся окислителями (хроматы, дихроматы, нитриты и др.). Они образуют на поверхности металлов пассивные оксидные плёнки (δ 0,1 мкм).
- Катодные – вещества, тормозящие отдельные стадии катодного процесса. Они либо снижают концентрацию кислорода в растворе (например Na2.SO3 ), либо сокращают поверхность катодных участков
( ZnSO4 , ZnCl2 и др.) за счёт образования нерастворимых гидроксидов
– например Zn(OH )2 , которые осаждаются на поверхности металла и изолируют катодные участки.
- Органические (альдегиды, амины и др.) адсорбируются на катодных участках, тормозя разряд водорода, а значит, и разрушение металла.
Б) Удаление из среды кислорода и замена его инертным газом.
Было замечено, что в кипячёной воде коррозия протекает медленнее, чем в сырой воде. Причина – при кипячении из воды удаляется значительная часть кислорода, в результате его концентрации в воде
уменьшается, |
а следовательно, скорость катодного процесса: |
|||
(+)K : 2H |
2 |
O + O + 4e = 4OH − |
– уменьшается, а значит, и уменьша- |
|
|
|
2 |
|
|
ется скорость растворения металла на аноде (эти процессы взаимосвязаны).
В) Снижение кислотности среды. (уменьшается скорость ка-
тодного процесса: (+)K : 2H + + 2e = H2 − .
190
