
химия + методичка / theory
.pdf
Ψ2 в этом районе максимальна.
Рис. 2.3. Распределение вероятности пребывания электрона в атоме водорода.
Можно сказать, что колеблется не сам электрон, а вероятность его обнаружения в том или ином месте атома.
Таким образом, атом вследствие волновой природы электрона
не имеет точных геометрических размеров и неизменной формы.
Электрон в атоме – волновой объект. Однако потеря атомом электрона (ионизация атома) всегда происходит в виде единого и не-
делимого электрона как частицы.
2.7. Строение электронных оболочек атомов. Квантовые числа
Интегрируя уравнение Шредингера, находят волновую функцию Ψ=f(x,y,z). Определив Ψ, можно оценить величину Ψ2 dV – веро-
ятность нахождения электрона в объёме пространства dV, окружающего атомное ядро.
Следствием решения уравнения Шредингера являются три квантовых числа, характеризующих поведение электрона в атоме.
2.7.1. Главное квантовое число (n)
Главное квантовое число характеризует (в первом приближении) общую энергию электрона или его энергетический уровень.
Оно определяет размеры атомной орбитали. Чем больше «n», тем больше размер атомной орбитали, значит, электрон находится дальше от ядра, следовательно, выше его энергия.
Для n=1 – возможно одно решение уравнения Шредингера.
Для n=2 – возможно четыре, для n=3 – девять решений уравнения Шредингера и т.д. В общем, для каждого значения «n» возможны «n2» решений.
21
Эти решения представляют собой орбитальные волновые функции, или орбитали электрона.
Понятие «орбиталь» не следует отождествлять с понятием «орбита», которое используется в теории Бора. Под орбитой в теории Бора понимается траектория движения (путь) электрона вокруг ядра.
Орбитали можно представить как некоторые области вокруг ядра, к которым электроны имеют доступ (но не всегда их заполня-
ют). Это геометрическое место точек, где вероятность нахождения электронов в возбуждённом состоянии максимальна (~95%).
Поскольку электрон имеет отрицательный заряд, его орбиталь можно рассматривать как некоторое распределение заряда. Такое распределение называют ещё электронным облаком.
Совокупность электронов с одинаковым значением «n» называют энергетическим уровнем (или оболочкой, или электронным сло-
ем). В невозбуждённых атомах максимальное значение «n» соответствует номеру периода данного элемента в таблице Д.И. Менделеева.
Энергетические уровни иногда обозначают большими буквами
латинского алфавита. |
|
|
|
|
Значение «n»: |
1 2 |
3 4 |
5 6 |
7 |
Обозначение уровня: |
K L |
M N |
O P |
Q |
(чаще всего используются цифровые обозначения).
2.7.2. Орбитальное квантовое число (l)
Орбитальное квантовое число определяет форму электронного облака (однако это однозначно лишь для одноэлектронного атома водорода).
В многоэлектронных атомах l характеризует так же и энергию. В этих атомах электроны данного энергетического уровня группируются в подуровни, обладающие различной энергией.
Каждому значению l соответствует определённый энергетиче-
ский подуровень. Совокупность электронов с одинаковыми «n» и «l» называют подуровнем (или подоболочкой).
Орбитальное квантовое число принимает значения от 0 до (n-1): 0,1,2,3,…….(n-1).
Чаще значение «l» вместо цифр выражают строчными цифрами латинского алфавита.
l= 0 1 2 3 … |
(2.9) |
|
обозначение s p d f …. |
||
|
22
(Больше четырёх подуровней в невозбуждённых атомах не заполняется, так как значения l=0,1,2,3 описывают электроны всех известных сейчас элементов).
|
|
Таблица 2.1 |
|
Связь между главными и орбитальными квантовыми числами |
|||
|
|
|
|
уровень |
Квантовое число (n) |
Значение орбиталь- |
|
|
|
ного квантового чис- |
|
|
|
ла (l) |
|
K |
1 |
0 (s-) |
|
L |
2 |
0,1 (s-, p-) |
|
M |
3 |
0,1,2(s-, p-, d-) |
|
N |
4 |
0,1,2,3 (s-, p-, d-, f-) |
|
|
z |
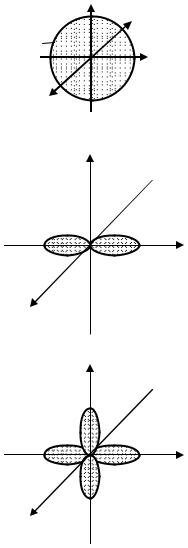
Орбитали, для которых l=0, |
имеют |
||||
1s |
форму шара (сферы) |
и |
называются |
s- |
|||
|
|||||||
|
орбиталями (условно изображают в |
виде |
|||||
|
|
||||||
y |
x |
окружностей). |
|
|
|
|
|
|
Электроны с l=0 называются s-электронами. |
||||||
|
|
||||||
|
|
Как видно из таблицы 2.1, s-орбиталь есть |
|||||
|
z |
на всех энергетических уровнях. На первом |
|||||
|
энергетическом уровне имеются только s- |
||||||
|
|
орбитали. |
|
|
|
|
|
|
|
Орбитали, для которых l=1, имеют |
|||||
|
x |
форму гантели (объёмной восьмёрки) и на- |
|||||
|
|
зываются p-орбиталями (электроны – p- |
|||||
|
|
электронами). p-орбитали есть на всех |
|||||
y |
|
уровнях, кроме первого. |
|
|
|
|
|
|
|
Орбитали с l=2 имеют |
более сложную |
||||
|
|
форму (объёмный «клеверный лист») и на- |
|||||
|
z |
зываются d-орбиталями. |
|
|
|
|
|
|
|
d-орбитали есть на всех уровнях, кроме пер- |
|||||
|
|
вого(n=1) и второго (n=2). |
|
|
|
||
|
x |
Орбитали с l=3 (f-орбитали) ещё |
|||||
|
|
сложнее, чем d-орбитали. Они находятся, |
|||||
|
|
начиная с четвертого уровня. |
|
|
|
||
y |
|
Энергия орбиталей |
(подуровней), |
ко- |
|||
торые находятся на одном энергетическом уровне, неодинаковы и возрастают в ряду:
Еs<Ep<Ed<Ef
23

Распределение подуровней по энергии показано на графике
(рис. 2.4).
Энергетический подуровень обозначают так: главное квантовое
число записывается арабской цифрой, |
орбитальное – соответствую- |
|||||
щей латинской буквой. |
|
|
|
|
||
Е |
|
4f |
|
|||
|
4d |
|
||||
4 |
|
|
|
|||
|
|
|
4p |
|
||
|
|
|||||
|
|
|
|
3d |
|
|
|
|
|
|
4s |
|
|
3 |
|
|
|
3p |
|
|
|
|
|
3s |
|
||
|
|
|
|
|||
|
|
|
|
2p |
|
|
2 |
|
|
|
2s |
|
|
|
|
|
||||
|
|
|
|
|||
1 |
|
|
|
1s |
|
|
Уровни |
|
Подуровни |
||||
|
|
|||||
Рис. 2.4. Cхема подразделения энергетических уровней на подуровни.
Например: 4d – это d-подуровень четвёртого энергетического уровня (n=4, l=2).
Число значений l для каждого уровня равно числу значений главного квантового числа (см. таблицу 2.1), поэтому число подуровней на уровне тоже равно главному квантовому числу «n».
2.7.3. Магнитное квантовое число (ml)
Магнитное квантовое число характеризует ориентацию электронного облака в пространстве относительно магнитного поля.
Оно определяет вытянутость электронного облака по осям, т.е. смещение его в пространстве по оси, совпадающий с направлением магнитного поля.
«ml» может принимать любые целые положительные и отрицательные значения от –l до +l, включая и ноль.
Число значений «ml» определяет число орбиталей на данном подуровне.
Например: s-подуровень: l=0 → ml= 0 → 1 орбиталь p-подуровень: l =1 → ml= –1, 0, +1 → 3 орбитали d-подуровень: l =2 → ml= –2, –1, 0, +1, +2 → 5 орбиталей
f-подуровень: l =3 → ml= –3, –2, –1, 0, +1, +2, +3 → 7 орбиталей.
24

В общем, число орбиталей на подуровне равно ml=2l+1 (2.10). Графически любая орбиталь изображается в виде клетки (квантовой
ячейки) □, а электрон в ней – в виде стрелки .
s-подуровень: p-подуровень: d-подуровень: f-подуровень:
Общее число орбиталей на энергетическом уровне равно:
Nорб= n2 |
(2.11) |
Учитывая что, как отмечалось выше, подуровни в пределах данного уровня отличаются по энергии, часто, чтобы это подчеркнуть, их графически изображают «ступенчато»:
4s |
4p |
4d |
|
4f |
|
0 -1 |
|
-2 -1 0 +1 +2-3 -2 -1 0 +1 +2 +3 |
0 +1 |
||
Итак, каждая орбиталь и электрон, который находится на этой орбитали, характеризуется тремя квантовыми числами – главным (n), орбитальным (l) и магнитным (ml).
Таблица 2.2
Число орбиталей на энергетических уровнях
Энерге- |
Главное |
Зна- |
обозначе- |
Значение ml |
Число |
Число |
|
тиче- |
кванто- |
чение |
ние поду- |
|
орбиталей |
орбита- |
|
ский |
вое |
l |
ровней |
|
на поду- |
лей на |
|
уровень |
число n |
|
|
|
ровне |
уровне |
|
K |
1 |
0 |
1s |
0 |
1 |
1 |
|
L |
2 |
0 |
2s |
0 |
1 |
4 |
|
1 |
2p |
-1, 0, +1 |
3 |
||||
|
|
|
|||||
M |
3 |
0 |
3s |
0 |
1 |
9 |
|
1 |
3p |
-1, 0, +1 |
3 |
||||
|
|
2 |
3d |
-2, -1, 0, +1, +2 |
5 |
|
|
|
|
0 |
4s |
0 |
1 |
|
|
N |
4 |
1 |
4p |
-1, 0, +1 |
3 |
16 |
|
2 |
4d |
-2, -1, 0, +1, +2 |
5 |
||||
|
|
|
|||||
|
|
3 |
4f |
-3,-2,-1,0,+1,+2,+3 |
7 |
|
25

Электрон характеризуется ещё одним – спиновым квантовым числом.
2.7.4. Спиновое квантовое число (ms )
«ms» характеризует внутреннее движение электрона – спин.
Оно связано с собственным магнитным моментом электрона, обусловленным его движением вокруг своей оси.
Упрощённо говоря, «ms» выражает направление вращении электрона вокруг своей оси.
Это квантовое число принимает только два значения:
+ 12 и − 12
Если направления вращения электрона вокруг ядра и вокруг своей оси совпадают (например, по часовой стрелке), то «ms» принимает значение +1/2  , а если не совпадают, то -1/2 .
, а если не совпадают, то -1/2 .
Два электрона с одинаковыми значениями n, l и ml , но с противоположно направленными спинами (антипараллельными) называются спаренными или неподелённой парой электронов 
 . Электроны с ненасыщенными спинами называются неспаренными (или «холосты-
. Электроны с ненасыщенными спинами называются неспаренными (или «холосты-
ми») 

 .
.
Орбиталь, на которой нет электронов, называется вакантной  .
.
2.8. Строение многоэлектронных атомов
Запись распределения электронов в атоме (или электронная конфигурация элемента) по уровням, подуровням и орбиталям приводится для основного (невозбуждённого) состояния атома. В случае, если один или несколько атомов находятся в возбуждённом состоянии, то и электронная конфигурация будет характеризовать возбуждённое состояние атома.
При записи электронной конфигурации указывают цифрами главное квантовое число (n), буквами – подуровни (s, p, d, f), а степень к буквам – число электронов на данном подуровне.
Например, 4d3 – на d-подуровне четвёртого энергетического уровня находится 3 электрона.
Водород – 1s1 Литий – 1s22s1
Магний – 1s22s22p63s2 и т.д.
Распределение электронов по орбиталям в атомах определяется тремя основными положениями:
- принципом Паули;
26

-принципом наименьшей энергии;
-правилом Гунда.
2.8.1. Принцип Паули (1925г)
На основании анализов спектров элементов и их положений в Периодической системе Паули вывел важнейший принцип: В атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел, т.е. два любых электрона в атоме должны отличаться по крайней мере значениями одного квантового числа.
Или: на орбитали может находится не более двух электронов, которые должны иметь противоположные спины.
Следствия из принципа Паули:
1. Ранее уже отмечалось, что число орбиталей на уровне равно квадрату главного квантового числа т.е.: Nорб=n2 , а так как на орбитали может находиться не более двух электронов, то:
Максимальное число электронов на уровне равно удвоенному значению квадрата главного квантового числа.
Nэл=2n2 |
(2.12) |
n=1: (Nэл=2·12=2 электрона) n=2: (Nэл=2·22= 8 электронов) n=3: (Nэл=2·32= 18 электронов) n=4: (Nэл=2·42=32 электрона)
2. Выше также отмечалось, что число орбиталей на данном подуровне равно числу значений магнитного квантового числа для этого подуровня (ml = 2l + 1), а так как на орбитали может быть не более двух электронов, то:
Максимальное число электронов на подуровне равно удвоенному числу значений магнитного квантового числа для этого подуровня:
Nэл=2·(2l +1) |
|
(2.13) |
На s-подуровне: Nэл=2·(2·0+1) =2 электрона (s-электроны); на p-подуровне: Nэл=2·(2·1+1) =6 электронов (p-электроны); на d-подуровне: Nэл=2·(2·2+1) =10 электронов (d-электроны); на f-подуровне: Nэл=2·(2·3+1) =14 электронов (f-электроны).
S |
|
P |
|
|
|
d |
|
|
|
|
|
f |
|
|
|
|
|
|
|
27

2.8.2. Принцип наименьшей энергии
Как уже отмечалось выше, наиболее устойчивое состояние электрона в атоме соответствует минимальному значению его энергии, а минимальной энергией обладает электрон, который находится на самой близкой к ядру орбите. Любое другое состояние является возбуждённым, неустойчивым – из него электрон самопроизвольно переходит в состояние с более низкой энергией.
Последовательность размещения электронов в атоме должна отвечать наибольшей связи их с ядром, т.е. электрон должен обладать наименьшей энергией.
Поэтому электрон не занимает вышележащего энергетического подуровня до тех пор, пока на нижележащем есть свободные места, располагаясь на которых электрон будет обладать наименьшей энергией.
s |
|
p |
s |
p |
|||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
неправильно |
правильно |
||||||||
Правила Клечковского:
1. Так как энергия электрона, в основном, определяется значениями главного и орбитального квантовых чисел, то сначала заполняется тот подуровень, для которого сумма n+l меньше.
Например, из двух подуровней 3d и 4s первым будет заполняться электронами подуровень 4s:
3d: (n+l=3+2=5) 4s→3d 4s: (n+ l =4+0=4)
2. Если для разных подуровней суммы n+l одинаковы, то сначала идёт заполнение подуровня с меньшим «n», т.к вклад в энергию электрона у «n» больше, чем у «l». Например, на подуровнях 5s, 4p и 3d суммы n+ l одинаковы: 5s: (5+0=5), 4p: (4+1=5), 3d: (3+2=5). Сле-
довательно, заполнение идёт по схеме: 3d→4p→5s.
2.8.3. Правило Гунда
Орбитали в пределах данного подуровня заполняются сначала по одному электрону, т.е. каждый электрон располагается в отдельной ячейке в виде неспаренного электрона. Данная закономерность обусловлена тем, что электроны отталкиваются друг от друга сильнее,
28
когда они занимают одну орбиталь. Поэтому они стремятся занимать различные орбитали, тогда отталкивание будет меньше (т.е. и меньше энергия). Одинаковое направление спинов также способствует уменьшению энергии; это связано с тем, что электроны, обладающие одинаковым спином, при движении избегают друг друга и, следовательно, меньше отталкиваются. Такая согласованность называется
корреляцией электронов.
Иными словами, при данном значении «l» электроны в атоме располагаются так, чтобы их суммарное спиновое число (Σms) было максимально. Рассмотрим, например, какое расположение трёх электронов на р-подуровне соответствует устойчивому состоянию атома:
1) 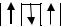 2)
2) 





 3)
3)  4)
4) 




 5)
5) 
Σms = |
|
|
|
1 |
2 |
− 1 |
2 |
+ 1 |
2 |
|
= 1 |
2 |
|
|
|
|
|
|
|
|||||||||||||||||
Σms = |
|
1 |
2 |
+ |
1 |
2 |
+ |
1 |
2 |
|
= |
3 |
2 |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
Σms = |
|
|
|
1 |
2 |
− 1 |
2 |
+ 1 |
2 |
|
= 1 |
2 |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
Σms = |
|
|
|
1 |
2 |
− 1 |
2 |
− 1 |
2 |
|
= |
|
− |
1 |
2 |
|
= 1 |
2 |
|
|||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
Σms = |
|
− |
|
1 |
2 |
− |
1 |
2 |
− 1 |
2 |
|
= |
|
− 3 |
2 |
|
= |
3 |
2 |
|||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||
Максимальным абсолютным значением суммарного спина характеризуются состояния 2 и 5. Поэтому именно они соответствуют устойчивому состоянию атома.
Пример. Охарактеризовать четырьмя квантовыми числами состояния электронов в атоме:
|
|
3s |
|
|
|
3p |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
3 4 |
5 |
6 |
|
|
||
|
|
1 2 |
|
|
||||||
№ |
n |
|
l |
|
|
ml |
ms |
|||
электрона |
|
|
|
|||||||
1 |
3 |
|
|
|
0 |
|
0 |
1/2 |
||
2 |
3 |
|
|
|
0 |
|
0 |
-1/2 |
||
3 |
3 |
|
|
|
1 |
|
-1 |
1/2 |
||
4 |
3 |
|
|
|
1 |
|
-1 |
-1/2 |
||
5 |
3 |
|
|
|
1 |
|
0 |
1/2 |
||
6 |
3 |
|
|
|
1 |
|
1 |
1/2 |
||
Установленный на основе спектроскопических, химических и рентге-
29
носкопических данных порядок заполнения орбиталей электронами следующий:
1s2 | 2s22p6 | 3s23p6 | 4s23d104p6 | 5s24d105p6 | |
6s25d14f145d2÷106p6 | |
|
7s26d15f146d2÷10…7p6| |
(2.14) |
|
Например, по приведенной формуле составим схему заполнения |
||
электронных орбиталей: |
|
|
Циркония |
40Zr: 1s22s22p63s23p64s23d104p65s24d2 |
|
Фермия |
100Fm:1s22s22p63s23p64s23d104p65s24d105p66s25d14f145d96p67s2 |
|
|
6d15f11. |
|
В зависимости от того, какой подуровень заполняется электронами последним, различаются:
s-элементы – в их атомах последним заполняется электронами s-подуровень внешнего уровня (в таблицах они чаще всего окрашены в красный цвет);
р-элементы – в их атомах последним заполняется электронами (от 1 до 6) р-подуровень внешнего уровня (оранжевый цвет);
d-элементы – в их атомах последним заполняется электронами (от 1 до 10) d-подуровень предвнешнего уровня, а во внешнем уровне у большинства из них находятся два электрона (s2).
Впоследствии, на основании тонких спектральных исследований было установлено, что не у всех 32-х d-элементов во внешнем уровне (ns) содержатся по два электрона.
У 9 элементов: Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au – по одному
(ns1), а у палладия (Pd) отсутствуют оба электрона (5s0).
Это связано с «проскоком» (или «провалом») электронов с внешнего s-подуровня на предвнешний d-подуровень (у девяти элементов «проваливается» один электрон, а у палладия – два). «Проскок» или «провал» характеризуется экзотермическим эффектом и приводит к более устойчивой конфигурации (d-элементы – синего цвета).
f-элементы – в их атомах последним заполняется электронами f-подуровень третьего уровня, считая от внешнего (обычно черного цвета).
ГЛАВА 3. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
Основной закон химии – периодический закон был открыт Д.И.Менделеевым в 1869г. Он сформулировал его следующим образом:
30
