
химия + методичка / theory
.pdf
пользуют в качестве активной массы катода. Наиболее распространенный деполяризатор – диоксид марганца MnO2.
В качестве примера рассмотрим элемент марганцевой деполяризации (элемент Лекланше) – см. рис. 10.1.
Катодом (+) в нем служит диоксид марганца (MnO2), уплотненный вокруг угольного стержня, а Анодом (–) – цинк.
Электролит – водный раствор хлорида аммония NH4Cl (или KOH) + загуститель – пшеничная мука или опилки.
Электрохимическая схема этого гальванического элемента имеет вид:
ē
(−)Zn NH4Cl MnO2 (C)(+)
Работу элемента можно представить так. При замыкании внешней цепи электроны с Zn – электрода переходят к графитовому стержню:
(−)Aнод : 2Zn0 − 4e = 2Zn2+
Образующиеся ионы цинка переходят в раствор электролита и связываются молекулами аммиака в комплексный ион:
2Zn2+ + 4NH 4Cl = [Zn(NH3 )4 ]Cl2 + ZnCl2 + 4H +
ē
К + 


 – А
– А
1
2  3
3  4
4
Рис.10.1. Элемент Лекланше: 1 – цинковая коробка (-) электрод; 2 – электролит; 3 – деполяризатор ( MnO2 ); 4 – графитовый стержень (+) электрод.
171
Электроны перемещаются к катоду (+) по внешней цепи, а ионы
Н+ идут к катоду (+) по внутренней цепи.
Если бы не было деполяризатора, то на катоде восстанавливался бы водород:
(+)K : 2H + + 2e = H2 −
Водород тонким слоем покрывал бы графитовый стержень и препят-
ствовал бы новым ионам Н+ подходить к катоду и принимать элек-
троны, т.е. поляризовал бы катод и элемент прекратил бы работу.
В присутствии же MnO2 происходит реакция:
4+ |
3+ |
(+) Катод: 4H + + 4MnO |
+ 4e = 4MnO(OH ). |
2 |
|
Водород уже не выделяется, т.к. MnO2 – хороший деполяризатор. Марганцево-цинковые батареи выпускаются самых разнообраз-
ных видов, с напряжением от 3 до 102 В и емкостями от 0,5 до 30 А/час. Массы батарей от 100 г до 20 кг.
10.2. Аккумуляторы
Аккумулятор – это обратимый гальванический элемент, который после разрядки вновь может быть заряжен пропусканием постоянного электрического тока в обратном направлении.
Этим он отличается от необратимого гальванического элемента, который используется лишь однократно. Отдельные гальванические элементы аккумулятора обычно соединены последовательно в батареи, чтобы обеспечить необходимое напряжение.
Преимущества аккумуляторов:
-высокий КПД;
-экологическая чистота;
-бесшумность;
-автономность;
-мощность – от долей ватта до 5000 кВт. Недостатки:
-малая удельная энергия (30…50Вт× ч/кг );
-дорогие – примерно в 5 раз дороже двигателей внутреннего сгорания на единицу мощности.
В зависимости от вида электролита применяют кислотные и
щелочные аккумуляторы.
172
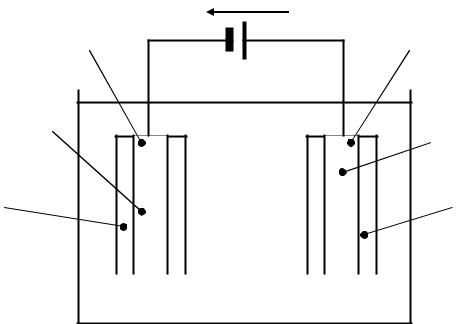
10.2.1. Кислотный (свинцовый) аккумулятор
Это наиболее распространенный вид аккумулятора. Его электродами являются перфорированные свинцовые пластины, отверстия которых заполняются пастой, содержащей оксид свинца PbO.
Электролитом служит 25…30%-ая H2SO4 (ρ=1,18-1,22 г/см3).
До зарядки: При заполнении аккумулятора кислотой на поверхности пластин образуется слой труднорастворимого сульфата свинца
(сульфатирование). PbO+H2SO4=PbSO4+H2O.
Образование большого количества PbSO4 портит аккумулятор, поэтому для его хранения без работы H2SO4 из него удаляют и промывают водой.
Зарядка (электролиз). Чтобы зарядить аккумулятор, т.е. накопить в нем химическую энергию, надо одну из пластин соединить с отрицательным, а другую – с положительным полюсом источника постоянного тока:
(–) катод: PbSO4 + 2e = Pb + SO42− |
||
(+) анод: PbSO4 + 2H2O − 2e = PbO2 + SO42− + 4H + |
||
Суммарно: 2PbSO4 + 2H2O = PbO2 + Pb + |
4H + + 2SO2− |
|
1442443 |
||
|
|
2H2SO4 |
|
|
серная кислота |
|
ē |
|
К(–) |
|
(+) А |
– |
+ |
|
Pb |
|
Pb |
|
|
|
Pb |
|
|
|
PbO2 |
(E = – 0.36В) |
|
|
|
(E = 1.68В) |
|
|
|
|
|
|
раствор H2SO4 |
|||
173

Из приведенных уравнений видно, что при зарядке аккумулятора образуется серная кислота, а вода вступает в реакцию (т.е. расходуется).
Это значит, что концентрация H2SO4 в растворе повышается. Аккумулятор заряжается до тех пор, пока не начнется электролиз воды с энергичным выделением водорода на катоде, а кислорода – на аноде («кипение аккумулятора»).
(-) Катод: 2H2O + 2e = H2 − +2OH −
(+) Анод: 2H2O − 4e = O2 − +4H +
Итак, при зарядке аккумулятора на одном электроде образуется диоксид свинца PbO2 (Е=1,68 В), а на другом – губчатый свинец Pb (Е= – 0,36 В). Т.е. при зарядке электроды становятся химически раз-
личными и между ними появляется разность потенциалов.
Электрическая схема полученного гальванического элемента
имеет вид:
ē
(−)Pb(Pb) H2SO4 + H2O PbO2 (Pb)(+)
Если соединить пластины заряженного аккумулятора проводником, то от пластины, покрытой губчатым свинцом, к пластине, покрытой диоксидом свинца, будут перемещаться электроны, т.е. поя-
вится электрический ток.
Разрядка (гальванический элемент).
При разрядке аккумулятор работает как гальванический элемент.
|
ē |
|
нагрузка |
A(-) |
(+)К |
PbSO4 |
PbSO4 |
Pb |
PbO2 |
|
Раствор H2SO4 |
174
Схема процесса:
(-) анод: Pb − 2e + SO42− = PbSO4
(+) катод: PbO + 2e + 4H + + SO2+ |
= PbSO + 2H |
O |
||
2 |
4 |
4 |
2 |
|
Суммарно: Pb + PbO2 |
+ 4H + + 2SO2− |
= 2PbSO4 + 2H2O |
||
|
1442443 |
|
|
|
|
2H2 SO4 |
|
|
|
Т.к. при разрядке аккумулятора образуется вода и расходуется серная кислота, то концентрация H2SO4 в растворе уменьшается.
Это уменьшение концентрации кислоты служит показателем разряженности аккумулятора.
Сравнивая между собой процессы зарядки и разрядки аккумулятора, легко заметить, что они являются обратными друг другу и поэтому могут быть выражены одним общим уравнением:
зарядка
2PbSO4 + 2H2O ↔ Pb + PbO2 + 2H2SO4
разрядка
ЭДС свинцового аккумулятора равна 2В.
ЭДС = 1,68-(-0,36)=2,04В
Преимущества свинцового аккумулятора:
−большая электрическая емкость (ампер·час);
−устойчивость в работе;
−большое количество циклов (разрядка-зарядка);
−высокий КПД (до 80%).
Недостатки:
−большая масса, а значит, малая удельная ёмкость (А× ч/кг);
−выделение водорода при зарядке;
−негерметичность при наличии концентрированного раствора кислоты.
В этом отношении лучше щелочные аккумуляторы.
10.2.2. Щелочные аккумуляторы
Наиболее распространёнными щелочными аккумуляторами являются:
а) кадмиево-никелевые аккумуляторы.
Эти аккумуляторы основаны на окислительно-восстановительном процессе с участием Ni3+:
175
3+ |
|
зарядка |
2+ |
2+ |
|
|
|||
2 Ni(OH )3 |
+ Cd ± 2e |
↔ |
2 Ni(OH )2 |
+ Cd (OH )2 |
|
|
разрядка |
|
|
Электролитом служит 23%-й раствор KOH (ρ=1,21 г/см3).
Эти аккумуляторы могут быть герметичными (ЭДС =1,2 В).
б) серебряно-цинковые аккумуляторы.
Эти аккумуляторы ценны по своим качествам:
−большая удельная ёмкость (А× ч/кг);
−высокая разность потенциалов, мало изменяющаяся во время разрядки.
Их работа основана на следующем окислительновосстановительном процессе:
зарядка
2AgO + 2Zn + 2H2O ± 2e ↔ 2Ag + 2Zn(OH )2
разрядка
Электролит – раствор КОН. Количество циклов разрядки – зарядки этих аккумуляторов ограничено ( 100). Щелочные аккумуляторы имеют срок службы больший, чем свинцовые и более устойчивы к сотрясениям, однако имеют меньший КПД (55…65%).
10.3.Топливные элементы (Т.Э.)
Внастоящее время 55% свинца расходуется на аккумуляторы. Через 40…60 лет с такими темпами свинца может не остаться на Зем-
ле (также и Ag, Ni, Cd, Zn).
Особое внимание за последнее время уделяется топливным элементам. Их преимущества:
−электроды не расходуются;
−удельная энергия выше, чем у аккумуляторов (400…800
Втч/кг);
−металлоёмкость – на два порядка ниже;
−мощность – до 1000 кВт.
Втопливных элементах химическая энергия топлива непосредственно преобразуется в электрическую энергию.
Вобычных тепловых системах процессы протекают по схеме:
176

Химическая энергия (горение топлива)
Тепловая энергия (получение пара)
Т.Э.
Механическая энергия (вращение турбины)
Электрическая энергия (вращение генерато-
Таким образом, топливные элементы обладают высоким КПД (до 85%). В качестве топлива используют чистый водород, спирты, гидразин (N2H4), некоторые металлы (Na и др.).
В отличие от обычных источников тока, в ТЭ активные массы конструктивно не связаны с электродами, а хранятся отдельно от них и из этих внешних хранилищ по мере расходования подаются внутрь источника тока.
Электроды, выполняющие, главным образом, роль токоподводов и своего рода катализаторов, при работе ТЭ не расходуются. Они должны быть высокоактивны, поэтому их изготавливают пористыми, с высокоразвитой поверхностью и они содержат катализаторы.
Рассмотрим устройство и действие водородно-кислородного ТЭ
(рис. 10.2):
Рис. 10.2. Водородно-кислородный топливный элемент.
Подводимый водород, являющийся топливом, адсорбируется на аноде, диссоциирует на атомы, а затем – ионизируется. В результате
177
на (-) Аноде возникает электродный потенциал. Электродный потенциал возникает и на кислородном электроде (+) Катоде. Величины их различны.
При замыкании внешней цепи проводником элемент генерирует ток (ЭДС = 1,23В).
Катодный и анодный процессы, происходящие на границе трех фаз: газ-жидкость-твердое тело, можно описать следующими уравнениями:
(−)A : Н2 ↔ 2H+ + 2e (+)K : Н2O +1/2O2 + 2e ↔ 2OH-
или в суммарном виде (складывая левые и правые части уравнений электродных реакций):
Н2 + 1/2O2 = H2O .
Преимущества ТЭ:
-большой срок службы (долговечность);
-надёжность в эксплуатации;
-экономичность (высокий КПД). Недостатки:
-малая скорость электродных процессов;
-трудность в подборе коррозионностойких материалов;
-высокие (иногда несколько сот градусов) в ряде случаев рабочие температуры.
Описанный Т.Э. был на корабле «Аполлон», совершившим посадку на Луне в 1969 г. (Мощность 100кВт). В процессе эксплуатации выработал 7000 кВт∙ч электроэнергии и 2 т. воды.
ГЛАВА 11. КОРРОЗИЯ МЕТАЛЛОВ
Коррозия – это самопроизвольный процесс разрушения металла вследствие физико-химического взаимодействия с окружающей средой.
В соответствии со II началом термодинамики, коррозия является самопроизвольным необратимым процессом, т.е. протекает с уменьшением энергии Гиббса (∆G):
Металлургия: |
Коррозия: |
Мen+ + ne = Me0 |
Me0 − ne = Men+ |
(∆G >0) |
(∆G<0) |
178
Почти все металлы находятся в природе в виде руд – соединений с неметаллами. Только благородные металлы (Au, Pt, Pd и др.) встречаются в самородном состоянии. Металлические руды образовались самопроизвольно в течении миллионов лет и представляют со-
бой естественные соединения металлов с неметаллами.
Затрачивая свободную энергию металлургического топлива или электроэнергию, можно разорвать химические связи и отделить металл от неметалла, т.е. восстановить его.
Но как только металл выходит из металлургической печи, он вновь возвращается в среду, содержащую те же вещества, которые однажды уже привели его в окисленное состояние. Всё начинается сначала. Т.е. коррозия – это необходимый по химическим законам переход металла в естественные для него в земных условиях химические соединения.
Коррозия приводит к большим потерям в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и т.п. Безвозвратные потери металлов составляют до 20% от ежегодного их выпуска. Это прямые потери. Однако во многих случаях косвенные потери от коррозии могут значительно превышать прямые потери. Например, выброс газа, нефти и других пожаро- и взрывоопасных веществ через отверстия в трубопроводах, образовавшиеся в результате коррозии, сможет привести к пожарам, взрывам с огромными материальными потерями, иногда к катастрофическому загрязнению окружающей среды, требующему колоссальных средств для его ликвидации и т. д. Например, в США потери от коррозии в 1975 г составляли 75 млрд. долларов.
Подсчитано, что металлофонд нашей планеты в виде машин, оборудования и сооружений составляет 6 млрд. тонн. Это лишь 30% произведённого за 3000 лет металла. Остальной металл ( 14 млрд. т.) исчез из обращения, в основном, из-за коррозии.
11.1. Виды коррозионных разрушений
По характеру поражения металлов различают следующие виды коррозионных разрушений:
а) равномерная коррозия ( 28%разрушений); б) пятнистая ( 10%); в) в виде язвы (слева) и питтинга ( 14%);
г) межкристаллитная ( 15%). Этот вид коррозии наиболее опасен. Металл разрушается по границам кристаллитов. При отсутствии
179
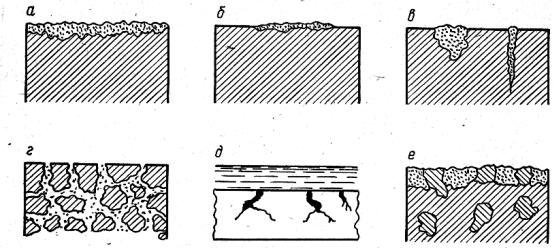
внешних изменений она значительно ухудшает механические свойства металлов (даже хромоникелевые стали склонны к этой коррозии при охлаждении после нагрева до 500…800°С);
д) коррозионное растрескивание ( 24%). Возникает в коррозионной среде при знакопеременных нагрузках.
е) в сплавах иногда наблюдается селективное (избирательное) коррозионное поражение более активного компонента, представляющего собой твёрдую кристаллическую фазу. Селективной коррозии подвержены как сплавы, имеющие структуру твёрдого раствора, так и сплавы с эвтектиками.
11.2. Основные виды коррозии
По механизму химических процессов различают два вида корро-
зии:
1)Химическую коррозию:
а) газовая коррозия; б) жидкостная коррозия.
2)Электрохимическую коррозию:
а) гальванокоррозия; б) электрокоррозия.
11.2.1. Химическая коррозия
При химической коррозии окружающая металл среда обычно не проводит электрического тока, а на поверхности металла не возникает электродный потенциал. Различают следующие типы химической коррозии:
180
