
химия + методичка / theory
.pdf
где: К – константа скорости реакции; 

 – концентрация кислорода
– концентрация кислорода
(концентрация углерода не учитывается); D – коэффициент диффузии (учитывает скорость подвода кислорода в зону реакции); S – площадь поверхности раздела фаз.
ЗДМ: Скорость гетерогенной реакции прямо пропорциональна произведению концентраций газообразных или растворенных веществ, возведенных в степени их стехиометрических коэффициентов, а также пропорциональна площади их реакционной поверхности
иинтенсивности перемешивания.
5.3.4.Влияние температуры на скорость реакции. Эмпирическое правило Вант-Гоффа
Температура очень сильно влияет на скорость реакции. Исходя из результатов многочисленных экспериментов, Вант-Гофф устано-
вил: При неизменной концентрации скорость большинства химических реакций увеличивается в среднем в 2…4 раза при повышении температуры на каждые 10оС.
ϑ |
=ϑ ×γ |
t2 −t1 |
|
10 |
(5.23) |
||
t2 |
t1 |
|
где 
 - скорость реакции при конечной температуре t2;
- скорость реакции при конечной температуре t2; 
 -
-
скорость реакции при начальной температуре t1; 
 - температурный коэффициент реакции
- температурный коэффициент реакции
γ = Kt +10 = 2...4
Kt
(Необходимо отметить, что γ=2…4 реализуется для реакций с Еакт=84…170 кДж/моль (большинство реакций). Однако Еакт может составлять от 40 до 400 кДж/моль, следовательно, γ может принимать значения от 1 до 10.
Пример:
При 0оС скорость некоторой реакции была υ0°C=1 моль/л∙мин. Как увеличится скорость этой реакции, если её проводить при 100 °С? (γ принять равными 2 и 3).
из 5.23: 






91
При γ=2: υ100°C =1·210=1024 моль/л·мин (скорость увеличилась в
1024 раза).
При γ=3: υ100°C =1·310=59000 моль/л·мин (скорость увеличилась в
59000 раз).
В химической практике более удобно оперировать временем (продолжительностью) реакции. А т.к. скорость обратно пропорциональна времени, выражение (5.23) можно записать:
1 |
|
|
1 ×γ |
t2 -t1 |
||||
= |
|
10 |
|
|||||
|
τt |
2 |
|
|
τt |
|
(5.24) |
|
|
|
|
1 |
|
|
|
||
В чем же причина такого огромного возрастания скорости? Может быть, сильно повышается число столкновений реагирующих частиц? Но опыт показывает, что число столкновений частиц при повышении температуры на 10°С возрастает лишь на 1…2%, что явно не соответствует наблюдаемому увеличению скорости.
Оказывается, что: С увеличением температуры резко возрастает число молекул, обладающих энергией, превышающей энергию активации, хотя общее число молекул остается постоянным.
Зависимость константы скорости реакции от температуры определяется по уравнению Аррениуса:
K = A×e |
- Eакт |
×e |
Sакт |
|
|
|
R×T |
R× |
(5.25) |
||
где А – предэкспоненциальный множитель (учитывает число соударений молекул. Его еще называют частотным фактором, т.к. он связан с частотой обратимого распада активированного комплекса).
5.3.5. Цепные реакции
Цепными называют реакции, в которых активная частица может вызвать не одно химическое взаимодействие, а несколько, передавая свою энергию возбуждения другим частицам.
Активными частицами могут быть:
a)возбужденные атомы ( H ∙ ,Cl ∙ );
b)ионы;
92
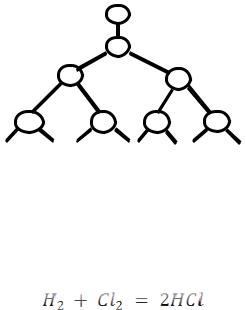
c) радикалы (осколки молекул, обладающие неспаренными электронами и проявляющие, вследствие этого, очень высокую реакционную способность).
Число превращений, вызванных одной частицей, определяет длину цепи, которая может исчисляться десятками тысяч вновь образовавшихся молекул. Так, для реакции образования хлорида водорода HCl из водорода и хлора каждая активированная частица (т.е. один поглощенный квант энергии) приводит к образованию 100 000 моле-
кул HCl.
Цепной механизм реакции был обнаружен М.А. Шиловым (1905 г.) и теоретически разработан Н.Н.Семеновым и Хиншельвудом, создавшим стройную теорию кинетики цепных реакций.
Рис. 5.4. Схема разветвленной цепной реакции.
Цепные реакции состоят из трех этапов: инициирование реакции
(зарождение цепи), рост цепи и обрыв цепи.
Рассмотрим в качестве примера реакцию образования хлорида водорода HCl из хлора и водорода:
Смесь водорода с хлором при комнатной температуре, как известно, на рассеянном свету может не взаимодействовать практически неограниченное время, т.к. двухатомные молекулы водорода и хлора достаточно прочны. Однако если ввести в эту смесь небольшое количество паров металлического натрия, то она прореагирует в форме взрыва.
Начало цепи: При обычных температурах молекулы паров натрия преимущественно одноатомны. Атомы Na очень активны в химическом отношении и легко вступают во взаимодействие с молекулами хлора:
Na + Cl2 = NaCl + Cl∙
Рост цепи: Образующиеся свободные атомы хлора (это отмечено точкой у символа) очень активны в химическом отношении и легко
93

вступают во взаимодействие с молекулами водорода, освобождая при этом атом водорода:
Cl∙ + H2 = HCl + H ∙
Свободный атом водорода, который тоже очень активен, взаимодействуя с молекулой хлора, тоже освобождает атом хлора, а последний, взаимодействуя с молекулой водорода, вновь освобождает атом водорода и т.д.:
H ∙ + Cl2 = HCl + Cl ∙
Cl∙ + H2 = HCl + H ∙
H ∙ + Cl2 = HCl + Cl∙
Длина цепи, как отмечалось выше, может измеряться тысячами и десятками тысяч отдельных звеньев.
Обрыв цепи: Обрыв цепи наступает при исчезновении активного центра, который может потерять свою избыточную энергию в следующих случаях:
а) Столкновение активных частиц друг с другом (аннигиляция радикалов):
Cl ∙ + Cl ∙ = Cl2
H ∙ + H ∙ = H2
H ∙ + Cl∙ = HCl
Освобождающаяся при этом энергия передается другим частицам. б) Столкновение активных частиц со стенкой сосуда или со стенками других предметов, находящихся в реакционном пространстве. В этом случае происходит перераспределение энергии активной
частицы между многими молекулами, составляющими стенку.
в) Столкновение с молекулами примесей, не вступающими в реакцию. В качестве примера практического использования этого явления можно указать на применение тетраэтилсвинца или пентакар-
бонила железа
C2H5 |
|
|
CO |
|
C2H5 |
CO |
|
CO |
|
|
Pb |
|
||
C2H5 |
|
Fe |
||
C2H5 |
|
|||
CO |
|
CO |
||
|
|
|
||
Тетраэтилсвинец |
Пентакарбонил железа |
|||
|
|
94 |
|
|
в качестве добавки в моторное топливо для предотвращения преждевременных микровзрывов паровоздушных смесей в цилиндрах двигателя (детонации). Продукты термического разложения этих веществ образуют в большом количестве твердые частицы, на поверхности которых происходит обрыв цепей. (Развитие новых цепей прекращается).
Энергия активации цепных реакций невелика (до 40 кДж/моль). Например, энергия активации рассматриваемой реакции
H ∙ + Cl2 = HCl + Cl∙
составляет всего 8 кДж/моль, т.е. на 1…1,5 порядка ниже энергии активации большинства химических реакций.
Цепные реакции достаточно широко распространены в природе и технике (процессы, протекающие в атмосфере; горение топлива; реакции полимеризации многих полимеров; окисление, галогенирование, высокотемпературное разложение углеводородов и др.)
5.3.6. Фотохимические реакции
Реакции, возбуждаемые действием видимого света или ультрафиолетового излучения, называются фотохимическими (ФХ).
Молекулы различных веществ поглощают свет избирательно, т.е. определенной длины волны. Поэтому, чтобы вызвать ФХреакцию, необходимо выполнить два условия:
1)Свет данной длины волны должен поглощаться какимлибо из реагирующих веществ.
2)Энергия поглощенного кванта "hν" должна быть не ниже энергии активации молекулы, его поглощающей.
Различают два вида ФХ-реакций:
В одних – химическое взаимодействие происходит в количествах, пропорциональных количеству света, поглощенного реагирующими веществами, т.е. такие реакции требуют постоянного подвода световой энергии (например, фотодиссоциация йодида водорода):
HI + hν = H ∙ + I ∙
В других реакциях поглощение света играет роль только возбудителя реакции, которая дальше протекает уже самопроизвольно, независимо от количества поглощенного света. Так происходит, например, возбуждение реакции между водородом и хлором в смеси этих газов при освещении ее прямыми лучами солнечного света или света от другого источника, богатого излучением в области фиолетовой или УФ-части спектра (смесь этих газов в рассеянном свете, как отмеча-
95

лось выше, может существовать бесконечно долго). Такие реакции называются фотокаталитическими. В этих реакциях поглощение света приводит к зарождению цепи, и далее реакция протекает по цепному механизму, как в рассмотренной выше реакции образования хлороводорода под действием паров металлического натрия.
Начало цепи:
hν |
∙ |
(два свободных радикала). |
Cl2 ¾¾®2Cl |
|
Рост цепи:
Cl∙ + H2 → HCl + H ∙
+
Cl2 → HCl + Cl∙
+
H2 → HCl + H ∙
+
Обрыв цепи (см. выше).
Из фотохимических реакций, идущих на Земле, наибольшее значение имеют:
1) Реакции фотосинтеза.
Эти реакции осуществляются растениями с помощью поглощаемой ими (а точнее, хлорофиллом) световой энергии в области красной части спектра. Основной реакцией фотосинтеза является реакция синтеза органического вещества из простых веществ – диоксида углерода и воды:
Конечными продуктами фотосинтеза могут быть самые разнообразные вещества – полисахариды, белки, жиры и т.д. (Ежегодно на Земле, по некоторым оценкам, с помощью фотосинтеза вырабатывается 1011 т кислорода и усваивается ~17,5∙1010 т углерода)
2) Атмосферное взаимопревращение кислород ↔ озон:
а) О2 + hν ® O∙ + O∙ üλ < 240нм O∙ + O2 ® O3(озон)ýþ
В этой реакции поглощается коротковолновая часть ультрафиолетового излучения Солнца, наиболее губительная для всех живых
96
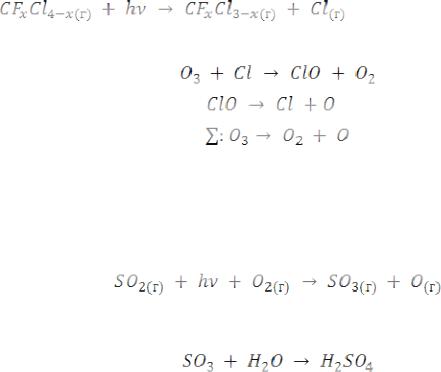
организмов и растений (~95%, и только 5% доходит до поверхности Земли).
б) O3 + hν → O∙ + O2 (λ < 300нм)
Таким образом, в атмосфере постоянно поддерживается определенное равновесие между озоном и кислородом, которые ограничивают доступ на Землю опасной для здоровья и жизни ультрафиолетовой радиации.
Скорость образования озона в стратосфере максимальна на высоте 30…50 км (“озоновый слой”). Учеными обнаружены так называемые “озоновые дыры”, т.е. области с пониженной концентрацией озона или с пониженной толщиной озонового слоя. Появление этих “дыр” связывают с деятельностью человека и прежде всего с неблагоприятным воздействием хлорфторметанов (фреонов) и оксида азота.
Так, хлорфторметаны оказывают неблагоприятное воздействие на озоновый слой из-за их фотолиза:
Образующийся хлор ускоряет разложение озона:
ФХ-реакции в тропосфере (на высоте ниже 10км, сюда проникает излучение с длинами волн более 300нм) вызывают образование многих экологически вредных соединений.
Так, диоксид серы SO2, попадающий в атмосферу, окисляется до триоксида серы:
Триоксид серы SO3 реагирует с H2O с образованием серной кислоты:
Серная кислота, растворенная в воде, выпадает на Землю в виде “кислотных ” дождей, вызывая многие неприятные экологические последствия.
5.3.7. Катализ
Катализ – это явление изменения скорости химических реакций под действием веществ, называемых катализаторами.
97
Катализатор – это вещество, изменяющее скорость реакции, но в результате реакции остающееся без изменения.
Катализ бывает:
а) положительный – приводит к ускорению химического взаимодействия;
б) отрицательный – приводит к замедлению химической реакции (например, ингибиторы коррозии).
Различают следующие типы катализа:
1)гомогенный – катализатор и реагирующие вещества находятся в одной фазе (ж+ж, г+г);
2)гетерогенный – реагирующие вещества и катализатор находятся в разных фазах (т+ж, т+г и др.);
3)биокатализ – осуществляется в растительном и животном мире с помощью ферментов – биокатализаторов белкового происхождения (например, в организме человека находится около 30 000 различных ферментов, каждый из которых служит катализатором соответствующей реакции).
Известны катализаторы, ускоряющие химические реакции во много миллионов раз. Характерная их особенность – они ускоряют
или замедляют реакцию даже тогда, когда находятся в реагирующей смеси в незначительных количествах (соотношение достигает 1:10-6).
Например, 1 моля биокатализатора (фермента каталазы) достаточно для разложения при 0°С за 1 с 100000 молей пероксида водоро-
да H2O2.
Катализаторы играют большое значение в промышленности химического синтеза. Примерно 70% химической продукции производится с применением катализаторов (получение серной и азотной кислот, синтетического каучука, аммиака, крекинг – процесс в нефтехимии и др.).
Вчем же причина такого резкого увеличения скорости реакции под действием катализатора?
Вбольшинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции, в результате чего молекулы, энергия которых была недостаточна для эффективных столкновений, становятся активными.
Гомогенный катализ. Этот катализ осуществляется через промежуточные реакции с катализатором, в результате чего происходит замена одной реакции с высокой энергией активации (медленной) не-
98
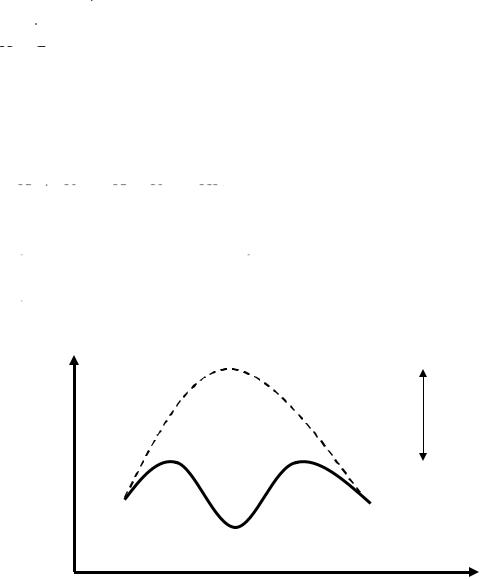
сколькими, у которых энергия активации ниже, а следовательно, скорость их выше.
Пример:
Реакция 



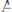

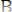 может быть проведена по двум вариантам: I.)
может быть проведена по двум вариантам: I.)


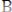






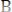



 (медленная реакция)
(медленная реакция)
(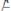




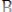 ) – Активированный комплекс (см. выше)
) – Активированный комплекс (см. выше)
В силу высокой Еакт эта реакция протекает медленно, т.е. с очень малой скоростью (рис.5.5).
Пусть найдено третье вещество К (катализатор), которое легко вступает во взаимодействие с А, образуя соединение АК (в силу меньшей Еакт и другой природы реагирующих веществ)
II.)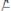





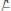







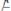


 (быстрая реакция)(2).
(быстрая реакция)(2).
Затем соединение АК легко взаимодействует с веществом В (в силу той же причины), образуя вещества АВ и К:
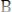












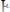




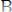


 (быстрая реакция)(3). Суммируя уравнения 2 и 3, получим:
(быстрая реакция)(3). Суммируя уравнения 2 и 3, получим:





 (быстрая реакция), т.е. в результате реакции катализатор остался без изменения.
(быстрая реакция), т.е. в результате реакции катализатор остался без изменения.
Е |
А |
× ×× В |
|
Еакт.
|
А ××× К |
АК × × × В |
||||
А + В |
|
|
АВ |
|
||
|
|
|
|
|||
А + В + К |
|
|
А + В + К |
|||
АК
τ
Рис. 5.5. Схема механизма гомогенного катализа.
∆Еакт – снижение энергии активации под влиянием катализатора. Пример гомогенного катализа:
SO + |
1 |
O = SO |
(υ ) |
||
2 |
|||||
2 |
2 |
3 |
1 |
||
NO – катализатор:
NO + |
1 |
O = NO |
(υ |
) |
||
2 |
||||||
|
2 |
2 |
2 |
|
||
99
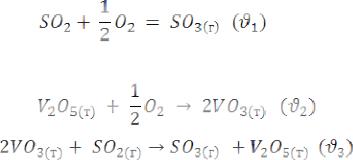
NO2 + SO2 = SO3 + NO (υ3 )
υ1 << (υ2 +υ3 )
Гетерогенный катализ. При гетерогенном катализе реакция протекает на поверхности катализатора.
Отсюда следует, что активность катализатора зависит от вели-
чины и свойств его поверхности. Для того, чтобы иметь большую
(“развитую”) поверхность, катализатор должен обладать пористой структурой или находиться в сильно раздробленном (высокодисперсном) состоянии.
Например, полированная пластинка из платины Pt, погруженная в раствор пероксида водорода H2O2 , не вызывает заметного его разложения, а пластинка с шероховатой поверхностью вызывает незначительное выделение пузырьков кислорода. Если же в раствор всыпать порошок Pt, наблюдается энергичное выделение кислорода. Мелкие частицы Pt, полученные электролизом, вызывают бурное разложение H2O2, а введение коллоидного раствора Pt сопровождается взрывом.
Схема гетерогенного катализа:
1)Диффузия – реагирующие вещества диффундируют к поверхности катализатора.
2)Адсорбция – реагирующие молекулы поглощаются активными центрами на поверхности катализатора.
3)Химическая реакция. Реагирующие молекулы, оказывающиеся рядом друг с другом, вступают в реакцию между собой с образованием продуктов реакции.
4)Десорбция. После завершения реакции молекулы продуктов реакции высвобождаются с поверхности катализатора.
5)Диффузия. Молекулы продуктов реакции диффундируют от поверхности.
Пример гетерогенного катализа:
Катализатор – V2O5(оксид ванадия):
100
