
химия + методичка / theory
.pdfреходит в виде соединения в водный раствор, из которого свободный металл выделяют или путём электролиза, или восстанавливают (вытесняют) более активным металлом. Этот метод применяют для извлечения металлов из бедных руд (например, оксидные руды Cu, Zn, V, Bi, Cd, Hg, Mo и др.).
Способ состоит из двух процессов:
1. Природное соединение (обычно оксид) растворяется в кислоте, в результате чего получается раствор соли этого металла:
CuO+H2SO4(разб)=СuSO4+H2O
2.Из полученного раствора металл извлекают:
–либо с помощью электролиза:
CuSO4 → Cu2+ + SO42-
(-) K: Cu2+ + 2ē = Cu0
(+)A: 2H2O – 4ē = O2↑ + 4H+
–либо вытесняют (восстанавливают) более активным металлом:
CuSO4+Fe=Cu+ FeSO4
Этим же способом добывают, например, золото. Руду, содержащую очень небольшие количества высокодисперсного самородного золота, после измельчения обрабатывают раствором цианида калия KCN. Всё золото переходит в раствор. Из раствора его извлекают электролизом или вытесняют металлическим цинком.
В настоящее время гидрометаллургическим способом получают более 25% всей добываемой меди, т.к. руды её остались, в основном, бедные и извлекать из них медь, например, с помощью карботермии, экономически невыгодно. Этот метод имеет большое будущее, т. к.
позволяет получать металлы, не извлекая руду на поверхность.
12.8.Получение металлов высокой чистоты
Сповышением чистоты металлов значительно улучшается ряд их технических свойств:
- увеличивается пластичность; - улучшаются электропроводность и теплопроводность;
- увеличивается коррозионная стойкость.
Например, Cr, Mn, V в обычном виде очень хрупкие, а в чистом виде – хорошо куются, прокатываются, протягиваются.
Современная техника требует применения металлов всё более высокой чистоты. Так, в атомной энергетике используются только
211
ультрачистые уран, торий, бериллий. Например, примесь бора B в уране не должна превышать 0,00001%, т. к. B может захватывать нейтроны.
В германии Ge для изготовления полупроводников не должно быть более 0, 0000001% меди и никеля.
Способы очистки разработаны ещё не для всех металлов. Обычно применяют следующие методы:
А. Химические методы.
1. Галидный способ (термическое разложение иодидов). Применяется для очистки таких тугоплавких металов, как цирконий , хром, титан, и др.
Схема процесса:
100−200O C 1300−1500O C
Ti( загр.) + 2I2 ¾¾¾¾®TiI 4(газ.) - ¾¾¾¾¾®Ti(чист.) + 2I2
Исходный загрязненный металл в виде порошка нагревается до 100 – 200 °С с небольшим количеством йода в герметичном аппарате, в котором натянуты титановые нити, нагреваемые электрическим током до 1300 – 1500 °С. Титан (но не примеси) образует с йодом летучий иодид титана TiI4, который разлагается на раскалённых нитях.
Выделяющийся чистый титан осаждается на них, а йод образует с исходным металлом новые порции иодида. Процесс идёт непрерывно до переноса всего металла на титановые нити.
2. Гидридный метод. Применяют тогда, когда гидриды примесей и основной материал резко отличаются по свойствам и их легко можно потом разделить обычными методами.
Например, теллур Te (полупроводник) содержит примеси серы S и селена Se, которые разделить обычными металлургическими методами не удаётся. Их разделяют, пропуская через расплав технического теллура (500°С) газообразный водород. Сера и селен образуют с водородом летучие соединения, а теллур – не реагирует:
S+H2=H2S↑ (летуч);
Se+H2= H2Se↑ (летуч);
Te+H2≠ .
Образовавшиеся гидриды H2S и H2Se резко отличаются по свойствам от теллура, и будут уноситься с потоком водорода, а чистый теллур остаётся в аппарате.
212
3. Метод транспортных химических реакций.
Рассмотрим этот метод на примере очистки никеля (карбонильный метод). Он состоит из трёх стадий:
I. Образование из металла и газообразного реагента летучего компонента в первой зоне:
t =80O C |
|
Ni + 4CO = Ni(CO)4 |
− (летуч) – карбонил никеля. |
II. Перенос образовавшегося летучего компонента из первой во вторую зону (в другой аппарат).
III. Разложение летучего компонента во второй зоне на теперь уже чистый металл и газообразный реагент:
t = 200O C
Ni(CO)4 = Ni(чист) + 4CO −
Газообразный реагент возвращается обратно в цикл. Метод основан на том, что примеси не образуют летучих компонентов и не переносятся во вторую зону, т. е. остаются в первой зоне.
5. Дистилляционные методы.
Наиболее распространённый из этой категории методов – перегонка и переплавка в вакууме. Этот метод основан на различной летучести металлов и примесей при нагревании в вакууме. При определённой температуре происходит отгонка примесей от менее летучего металла или, наоборот, отгонка более летучего металла от примесей с последующей конденсацией отгоняемого компонента.
6. Электрохимические методы.
Например, электролитическое рафинирование (см. выше). Напомним, что по этому методу очищаемый металл подключа-
ют к аноду – положительному полюсу источника постоянного тока и растворяют его, одновременно осаждая на катоде рафинированный металл, который свободен от примесей. Примеси остаются в растворе. Достигаемая степень чистоты – 99, 999%.
7. Кристаллизационные методы.
Рассмотрим в качестве примера метод, называемый зонной плав-
кой (рис. 12.5).
213

1 
 2
2
υ=1-10мм/час
5 |
4 |
3
Рис.12.5 Схема зонной плавки 1 – кольцевая электропечь; 2 – контейнер из термостойкого инертного материала; 3 –
брусок очищаемого металла; 4 – расплавленная зона; 5 – зона концентрации примесей (отрезаемая часть бруска).
Брусок очищаемого металла передвигается с небольшой скоростью (несколько мм в час) через кольцевую электропечь слева направо. В результате расплавляется небольшой участок бруска, находящийся в данный момент в зоне нагрева. По мере продвижения контейнера с бруском слева направо расплавленная зона перемещается от одного конца бруска к другому (справа налево).
Процесс очистки основан на том, что растворимость примесей
в жидкой фазе металла, как правило, значительно больше, чем в
твёрдой фазе. При кристаллизации примеси переходят в твёрдую фазу в гораздо меньшем количестве по сравнению с расплавом.
При медленном перемещении зоны расплава вдоль слитка примеси увлекаются расплавленной зоной, которая, обогащаясь ими, пе-
ремещается на левый край бруска.
Процесс повторяется 4 – 6 раз. По окончании очистки конец стержня, где сконцентрировались практически все примеси, отрезается. Соблюдая все меры предосторожности, можно получить таким способом металлы и другие материалы с содержанием примесей до
10−10 %. Естественно, такие методы очень дороги и употребляются только в исключительных случаях.
Необходимо иметь в виду, что перед этой финишной суперочисткой с помощью зонной плавки очищаемые металлы предварительно подвергаются очистке одним из перечисленных выше методов.
ГЛАВА 13 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИИ S- МЕТАЛЛОВ
Общие свойства s-металлов. Атомы s-металлов имеют на внешнем электронном уровне соответственно один или два электрона: ns1 или ns2. Степени окисления их ионов в большинстве случаев равны
214
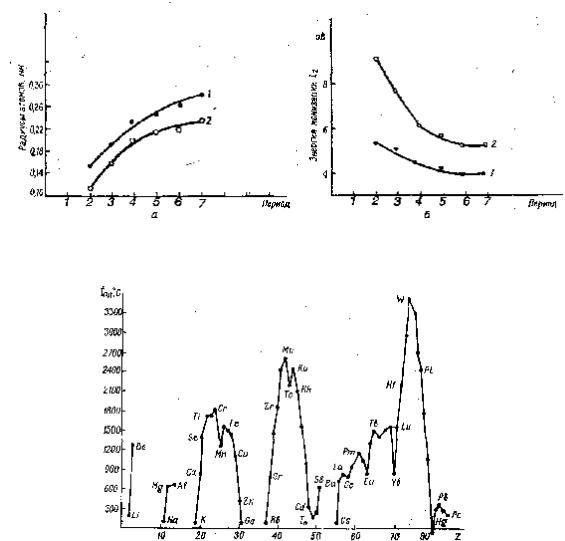
+ 1 и + 2. По мере увеличения порядкового номера атомов растут их радиусы и уменьшаются энергии ионизации (рис. 13.1). Простые вещества имеют кристаллическую решетку с относительно слабыми металлическими связями. Все s-металлы, кроме бериллия, имеют невысокие значения температур плавления (см. рис.13.2), твердости и прочности. Плотность этих металлов невелика и лежит в пределах 0,58 ÷ 3,76 г/см. Все s-металлы – сильные восстановители. Значения их стандартных электродных потенциалов ниже – 2,0 В (кроме бериллия, у которого – 1,65 В).
При взаимодействии с водородом s-металлы образуют ионные гидриды МН и МН2, которые в присутствии воды подвергаются гидролизу:
MH + H2O = MOH +H2
MH2 + 2H2O = M(OH)2 + 2H2
Рис.13.1 Металлические радиусы (a) и первые энергии ионизации (б) s-металлов первой
(1) и второй (2) групп периодической системы
Рис. 13.2. Периодическое изменение температуры плавления металлов
215
Реакция гидролиза гидридов используется для получения водорода в автономных устройствах. Гидриды металлов также используются для получения некоторых металлов. Все s-металлы, кроме бериллия и магния, бурно реагируют с водой (опасно) с выделением водорода:
M + H2O = MOH +1/ 2H2
M + 2H2O = M(OH)2 + H2
Реакционная способность s-металлов с водой возрастает с увеличением атомного номера в группе.
Вследствие своей активности щелочные и щелочноземельные металлы не могут находится в атмосфере, поэтому хранятся в запаянном состоянии в керосине или под слоем вазелина или парафина. Все s-металлы образуют оксиды, при растворении которых образуются щелочи. Оксид магния мало растворим в воде, его гидроксид Mg(OH)2 – имеет основный характер. Оксид бериллия амфотерен.
При взаимодействии с галогенами образуются хорошо растворимые в воде галогениды. Также хорошо растворимы в воде нитраты этих металлов. Растворимость сульфатов и карбонатов элементов II группы значительно меньше, чем у элементов I группы.
Щелочные металлы. Натрий Na, калий К, литий Li (0,0065 %) и рубидий Rb (0,015 %) относятся к распространенным, а цезий Cs (7·10-4 %) – к малораспространенным в земной коре элементам, а франций Fr – к искусственно полученным элементам.
Все они – очень химически активные вещества, причем их активность возрастает от лития к францию. Так рубидий и цезий реагируют с водой с взрывом, калий с воспламенением выделяющегося водорода, а натрий и литий – без возгорания. Они реагируют с большинством элементов и многими соединениями, с некоторыми из них, например галогенами и кислородом, с самовоспламенением или взрывом. С кислотами взаимодействуют бурно (опасно), восстанавливая их до низшей степени окисления, например:
8Na + 4H2SO4 = Na2S + 3Na2SO4 + 4H2O
Со многими металлами щелочные металлы образуют интерметаллиды.
Наименее активен из щелочных металлов литий. В щелочных растворах, например, он реагирует с водой относительно медленно из-за образования защитной оксидной пленки, поэтому разрабатываются химические источники тока (ХИТ) с литиевым анодом и ще-
216
лочным электролитом. Еще более устойчив литий в неводных растворах электролитов, например в пропиленкарбонатном (СзН6O2СO) или тионилхпоридном (SOCl2) растворах, что позволило создать ХИТ с литиевым анодом, неводными растворами электролитов и различными окислителями (MnO2, FeS2, CuO, S02, SOCl2 и др.). Так как литий имеет отрицательный потенциал и малую молекулярную массу, то удельная энергия этих ХИТ особенно при отрицательных температурах (t < 0°С), в 4 – 10 раз выше удельной энергии традиционных ХИТ.
Металлический литий применяется также в термоядерных реакторах для получения трития
63Li+01n=31H+42He
Легирующая добавка лития к алюминиевым сплавам улучшает их прочность и коррозионную стойкость, а к меди – электрическую проводимость. Натрий используется в металлургии для получения металлов и удаления мышьяка из свинца, а также в качестве жидкого теплоносителя в атомной энергетике и химической промышленности. Рубидий и цезий при освещении легко теряют электроны, поэтому служат материалами фотоэлементов.
Щелочи и соли щелочных металлов широко распространены и применяются, например, в машиностроении – для обезжиривания деталей, нейтрализации стоков (NaOH, Na2C03), в энергетике – для водоподготовки (NaOH, NaCl), для защиты от коррозии (смесь LiCl – LiOH), в металлургии (NaCl, КС1, NaNO3, KNO3), в химической промышленности (NaOH, Na2CO3), в быту (NaCl, Na2CO3), при сварке и пайке (LiF), в сельском хозяйстве (КС1, KNO3, K2SO4), медицине и т.д.
13.1 Бериллий и магний.
Магний Mg относится к наиболее распространенным на Земле элементам (масс. доля 2,1 %). Бериллий Be относительно мало распространен [6–10-4](масс. %), он характеризуется высокими температурой плавления (1278 С), твердостью и прочностью. Магний мягче и пластичнее бериллия, относительно легкоплавок (tпл = 650 ºС).
Светло-серый бериллий и серебристо-белый магний покрываются на воздухе оксидной пленкой, защищающей их от взаимодействия с кислородом и водой. Магний химически активнее бериллия. При нагревании оба металла сгорают в кислороде, а магний реагирует с водой. Галогены реагируют с Be и Mg и при обычных температурах. В
217
растворах кислот оба металла растворяются с выделением водорода, бериллий растворяется также в щелочах. Окислительные концентрированные кислоты пассивируют бериллий. Бериллий и магний образуют интерметаллиды со многими металлами. Бериллий применяется
ватомной энергетике как замедлитель нейтронов. Введение бериллия
вметаллические сплавы повышает их прочность, твердость, упругость и коррозионную стойкость. Особый интерес представляет бериллиевая бронза [сплав Cu–Ве, содержащий 2,5% Be (масс.)], из которой готовят пружины и другие упругие элементы приборов и устройств.
Магний, в основном, применяется в виде сплавов с другими металлами, сплавы электрон (с алюминием и цинком), магналий (с алюминием), МА 8 (с марганцем и церием) используются в авиационной технике и других отраслях. Магний и его сплавы применяют как протекторы для защиты от коррозии.
Гидроксиды бериллия и магния слабо, а большинство их солей хорошо растворимы в воде. Соли бериллия гидролизуются уже при комнатной, а соли магния – при повышенной температурах. Бериллий и его соединения – очень токсичны.
Из соединений магния наибольшее применения нашел MgO (наполнитель резины, в производстве огнеупоров и строительных материалов) и MgCl2 (в производстве магнезиального цемента).
ГЛАВА 14 ХИМИЯ Р-МЕТАЛЛОВ
Атомы p-металлов на внешнем электронном уровне имеют от одного до трех p-электронов, Таких элементов семь: алюминий, галлий, индий, таллий, олово, свинец, висмут. К металлам также иногда относят полуметаллы, такие как сурьма и астат. Нами будут рассмотрены алюминий, олово и свинец, как наиболее технически важные p- металлы.
14.1.Алюминий
Алюминий – белый металл, в обычных условиях покрыт тонкой
оксидной пленкой. Плотность ρ = 2,7 г/см3, tпл. = 660 ºС, tкип. = 2348 °С. Имеет хорошую тепло- и электропроводность (60 % Сu). Легко вытяги-
вается в проволоку, прокатывается в тонкие листы, хорошо сваривается, плохо обрабатывается резанием.
Нахождение в природе и получение. По распространенности в земной коре (8,8 %) он занимает первое место среди металлов и третье – среди всех элементов (после О2 и Si). Из-за высокой хими-
218
ческой активности Аl встречается в природе только в виде соединений. Существует 250 минералов, содержащих алюминий, половина из них – алюмосиликаты, которые составляют большую часть земной коры. Основное сырье для получения алюминия:
-бокситы (содержат до 60% глинозёма Al2O3);
-нефелин (Na2O·Al2O3·2SiO2);
-каолинит (Al2O3·2SiO2·2H2O);
-криолит (Na3[AlF6]) и другие.
Для получения алюминия обычно исходят из чистого оксида алюминия – глинозёма Al2O3.
Глинозём растворяют в криолите (Na3[AlF6]) и подвергают электролизу. В расплаве – 8 % Al2O3и 92 % криолита. Криолит в данном случае служит для снижения Т.пл. электролита, т. к. температура плавления чистого Al2O3 равна 2050 °С, а указанной эвтектической смеси – лишь 950 ºС, что является экономически целесообразным. Для улучшения хода процесса в расплав добавляют ещё фториды – CaF2, MgF2, AlF3, которые увеличивают электропроводность расплава.
Оксид Al2O3, в узлах кристаллической решётки которого находятся ионы Al и оксид – ионы, при расплавлении диссоциирует:
расплав: 2Al2O3→4Al3++6O2-
При электролизе протекают процессы: (-)K: 4Al3++12ē = 4Al0
(+)A: 6O2- – 12ē = 3O2↑
Электролитическое производство алюминия требует больших затрат электроэнергии (на получение 1т алюминия расходуется около 20000 кВт·ч). Поэтому заводы по его производству строят обычно рядом с гидроэлектростанциями, производящими дешёвую электроэнергию (Запорожская, Братская, Красноярская и др.).
Химические свойства. Алюминий относится к элементам III – А группы периодической системы. Его атомы характеризуются застройкой р-подуровня наружного уровня.
3s |
3p |
+E |
3s |
3p |
|
|
|
||
Al |
|
возбуждение Al* |
|
|
невозбужденное |
|
возбужденное |
||
состояние |
|
состояние |
||
219
Для алюминия характерна только валентность, равная III. Химические связи, образуемые Al с другими элементами, носят ковалентный характер.
а. Взаимодействие с простыми веществами.
Al – очень активный металл (E0Al/Al3+ = –1,66 B), обладает большим сродством к кислороду. В результате окисления при комнатной
температуре на его поверхности образуется прочная защитная плёнка оксида Al2O3, которая предохраняет металл от дальнейшего воздействия воздуха, влаги и др.
Мелко раздробленный Al энергично реагирует с кислородом воздуха, сгорая с выделением большого количества тепла.
2 Al + 3/2 O2 = Al2O3, ∆H = –1670 кДж.
При комнатной температуре Al взаимодействует с галогенами, образуя галиды:
2Al+3Cl2=2AlCl3 – хлорид Al; 2Al+3Br2=2AlBr3 – бромид Al.
Галиды очень гигроскопичны: AlCl3+2H2O=Al(OH)2Cl+2HCl – «дымят» на воздухе.
При 800 ºС Al реагирует с азотом, образуя нитрид AlN:
toC
2Al + N2 = 2AlN .
При 1000 ºС – реагирует с серой, образуя сульфид Al2S3:
toC
2Al + 3S = Al2S3
При 2000 ºС Al взаимодействует с углеродом, образуя карбид Al4C3, который разлагается водой с образованием метана.
С водородом Al не реагирует, но хорошо растворяет его (при 1000 ºС растворимость 0,2 см3 водорода на 1 см3 Al).
б. Взаимодействие со сложными веществами.
Алюминий, лишённый защитной плёнки, энергично реагирует с водой, вытесняя водород:
2Al + 6H2O = 2Al(OH)3 + 3H2↑.
При действии разбавленных сильных минеральных кислот и растворов щелочей он легко растворяется:
220
