
химия + методичка / theory
.pdf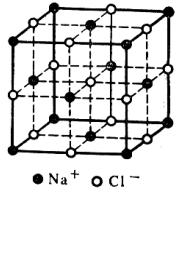
Деление на вещества с ковалентной связью и ионной связью условно и определяется преимущественным проявлением того или иного типа связи. Принято считать:
Если разность ЭО ≥ 2,1 – ионная связь.
Если разность ЭО от 0 до 2,1 – ковалентная полярная связь. Если разность ЭО=0 – ковалентная неполярная связь. Например, разность ЭО:
F–Li : 4,0 – 1,0=3,0 – ионная связь;
Cl–C : 3,0 – 2,5=0,5 – ковалентная полярная связь; Cl–Cl : 3,0 – 3,0=0 – ковалентная неполярная связь.
Соединения двух элементов, расположенных в противоположных концах одного (и разных) периодов, имеют преимущественно ионный характер связи, но по мере сближения элементов в пределах периода ионный характер их соединений уменьшается, а ковалентный
– увеличивается.
Например, хлориды и оксиды элементов левой части периодической системы имеют ионный характер, а хлориды и оксиды правой части периодической системы – преимущественно ковалентные соединения. Хлориды и оксиды промежуточных элементов имеют смешанный характер связи – ионный с большой степенью ковалентности.
По своим свойствам ионная связь отличается от ковалентной связи. Силы электростатического взаимодействия направлены от данного иона во все стороны. Поэтому данный ион может притягивать ионы противоположного знака в любом направлении. Этим обусловлена ненаправленность и ненасыщаемость ионной связи.
В кристаллической решётке ионных соединений вокруг каждого иона располагается определённое число ионов с противоположными знаками. Например, в кристаллической решётке хлорида натрия NaCl каждый ион Na+ окружён шестью ближайшими хлорид-ионами Cl-, а каждый хлорид-ион окружен шестью ионами натрия Na+ (т.е. координационное число ионов Na+ и Cl- равно 6).
Таким образом, для ионных соединений понятие «молекула» при обычных условиях теряет смысл.
51
Существуют вещества, молекулы которых содержат и ионные, и ковалентные связи. К таким веществам относятся, например, многие соли. Так, в молекуле сульфата натрия Na2SO4 связи между атомами натрия и кислорода представляют собой ионные связи, а остальные связи (между атомами кислорода и серы) – ковалентные полярные.
Na – O |
O |
|
S |
Na – O |
O |
По характеру распределения электронной плотности различают
неполярные и полярные молекулы (диполи).
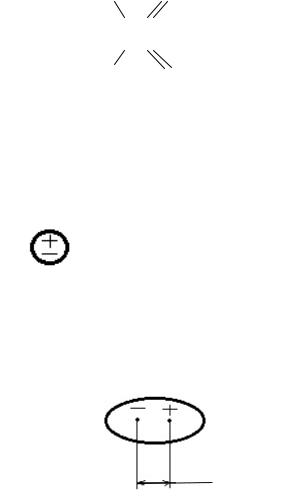
Молекулы с неполярными связями являются неполярными молекулами. У них центры тяжести положительных и отрицательных зарядов совпадают (дипольный момент равен 0)
или  l=0; μ=0
l=0; μ=0
Если молекула состоит из двух атомов, которые связаны полярной связью, то такая молекула является полярной молекулой, т.е. представляет собой диполь.
l
l > 0; μ > 0
Диполь – это электронейтральная система, в которой центры положительного и отрицательного зарядов находятся на определённом расстоянии друг от друга.
4.5. Донорно-акцепторная связь. (Д-А-связь) (Вернер,1893 г., Австрия)
Эта связь является разновидностью ковалентной связи. Как уже отмечалось выше, механизм образования ковалентной связи, при котором каждый атом предоставляет для создания общей электронной
52
пары один неспаренный электрон (с противоположным спином) называется обменным механизмом:
А  +
+ 
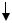
 B
B  А
А 

 B
B
Однако существует и другой механизм образования ковалентной связи, который называется донорно-акцепторным.
Д-А-связь возникает между атомами A и B в том случае, если атом A предоставляет в общее пользование имеющуюся у него свободную неподелённую пару электронов атому B, который имеет свободную орбиталь.
Атом A, который отдаёт свою неподелённую пару электронов называется донором, а атом B, принимающий эту пару электронов на свою свободную орбиталь, называется акцептором.
А |
+ |
B |
А |
B |
|
|
|
|
|
|
донор |
акцептор |
|
|
|
|
|
|
|||
Т.е. Д-А-связь образуется в результате перекрывания орбитали с |
||||||||||
неподелённой парой электронов атома – донора и свободной орбита- |
||||||||||
ли атома – акцептора. |
|
|
|
|
|
|
|
|
||
Д-А-связь имеет такие же свойства, как и ковалентная связь, и |
||||||||||
отличается от неё только происхождением общей электронной пары. |
||||||||||
Рассмотрим механизм образования Д-А-связи в процессе взаи- |
||||||||||
|
|
|
модействия |
аммиака |
NH3 |
и |
||||
2s |
2p |
|
трифторида |
|
бора |
|
BF3.Три |
|||
|
|
неспаренных |
|
электрона |
атома |
|||||
7N |
|
|
азота, которые находятся на |
2p- |
||||||
|
|
подуровне, |
|
участвуют |
в |
|||||
|
|
|
|
|||||||
|
|
|
образовании |
|
трёх |
ковалентных |
||||
ДА-связь |
|
|
связей с атомами водорода в мо- |
|||||||
|
|
лекуле NH3. Это обычные связи, |
||||||||
H |
H |
H |
||||||||
образованные |
по |
обменному |
||||||||
|
|
|
||||||||
|
|
5B |
механизму. |
|
|
|
|
|
||
|
|
|
Неподелённая пара электро- |
|||||||
|
|
|
нов, которая находится у атома |
|||||||
|
|
|
азота на 2s-подуровне, может уча- |
|||||||
|
|
|
ствовать в образовании Д-А- |
|||||||
F |
F |
F |
связей, т.е. атом азота в молекуле |
|||||||
NH3 |
может |
быть донором элек- |
||||||||
|
|
|
||||||||
|
|
|
53 |
|
|
|
|
|
|
|
тронной пары.
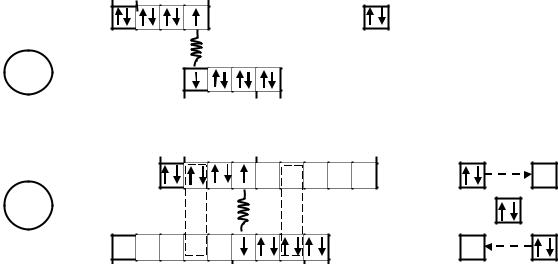
В молекуле BF3 у атома бора также имеются три неспаренных электрона (один 2s_ и два 2p_) которые образуют три ковалентных связи с тремя атомами фтора и одна свободная орбиталь, т.е. атом бора в молекуле BF3 является акцептором. В результате между молекулами NH3 и BF3 возникает Д-А-связь, которую изображают стрелкой, направленной от донора к акцептору.
4.6. Дативная связь
Разновидностью Д-А-связи является дативная связь, при которой один и тот же атом может быть одновременно и донором, и акцептором. В этом отношении представляет интерес механизм образования молекул галогенов, в которых энергия связи (Есв.) должна уменьшаться от фтора к йоду. В действительности же Есв:. F2 (156
кДж/моль), Cl2 (239,9 кДж/моль), Br2 (190 кДж/моль) и I2 (148,5
кДж/моль), т.е. видно, что энергия связи в молекуле фтора F2 меньше, чем в молекуле хлора Cl2.
Это можно объяснить тем, что в молекуле фтора образуется только ковалентная связь, а в молекуле хлора, благодаря наличию свободных d-орбиталей, возникают дативные связи и суммарная энергия связи больше (см. пунктир на схеме):
2s |
2p |
|
F |
F |
|
|
|
|
|
||
F2 |
|
|
|
|
|
|
2p |
|
2s |
|
|
|
3s 3p |
|
3d |
p |
d |
Сl2 |
|
|
|
Cl |
Cl |
|
3d |
3p |
3s |
d |
p |
Здесь каждый атом хлора является и донором, и акцептором электронов. Чтобы различить две такие связи для одного атома, до- норно-акцепторной принято называть ту связь, где атом – акцептор электронов, а дативной ту, где атом-донор электронов.
54
Наличие Д-А-связей в молекуле Cl2 сказывается на увеличении прочности связи Cl – Cl.
4.7.Межмолекулярные взаимодействия
Взависимости от внешних условий вещество может быть в га-
зообразном, жидком и твёрдом состояниях. (Возможно четвёртое состояние – плазменное. При температуре более 50000С молекулы термически диссоциировали и образовалась плазма – смесь непрерывно перемещающихся электронов, ионов и даже атомных ядер).
Одно агрегатное состояние отличается от другого характером взаимодействия молекул друг с другом.
Природа притяжения молекул во всех агрегатных состояниях одинакова – электрическая. Силы притяжения между молекулами – силы межмолекулярного взаимодействия – называются силами Ван- дер-Ваальса – по имени голландского учёного, который количественно обосновал теорию межмолекулярного взаимодействия. Эти силы зависят от расстояния между молекулами и характера самих молекул.
Типы сил взаимодействия:
1. Ориентационное взаимодействие – при взаимодействии по-
лярных молекул (притяжения типа: постоянный диполь – постоянный диполь). Осуществляется за счёт сил притяжения, обусловленных взаимодействием постоянных диполей (противоположно заряженные концы диполей притягиваются друг к другу).
2. Индукционное (деформационное) взаимодействие – при взаи-
модействии полярной и неполярной молекул. Электрическое поле полярной молекулы при сближении её с неполярной молекулой индуцирует диполь в неполярной молекуле вследствие деформации электронной оболочки последней. Это притяжение слабее дипольдипольного взаимодействия между постоянными диполями.
55
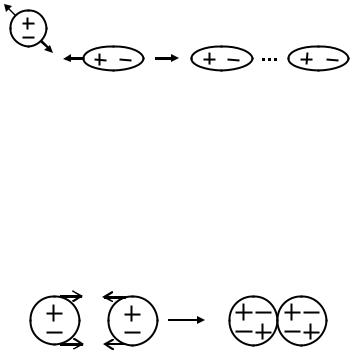
3. Дисперсионное взаимодействие – взаимодействие между не-
полярными молекулами (притяжение типа мгновенный диполь – индуцированный диполь).
Вследствие непрерывного движения электронов и колебательного движения ядер в каждом из атомов может произойти временное смещение некоторых электронных орбит относительно ядра и временное возникновение диполя. Эти мгновенные диполи индуцируют диполи в соседних молекулах и затем притягиваются друг к другу.
Дисперсионные взаимодействия намного слабее, чем силы притяжения типа постоянный диполь – постоянный диполь.
Вещества, состоящие из молекул и атомов, которые притягиваются друг к другу только дисперсионными силами (например, жидкие благородные газы ), характеризуются низкими температурами плавления и кипения по сравнению с другими веществами приблизительно такой же относительной молекулярной массы.
Межмолекулярные взаимодействия являются более слабыми, чем химическая связь. Если энергия химической связи 125…420 кДж/моль, то энергия межмолекулярного взаимодействия составляет 8…47 кДж/моль. Прочность межмолекулярных связей убывает в последовательности:
Eориент. > Eиндукц. > Eдисперс.
4.8. Водородная связь
Давно было замечено, что соединения, в которых атом водорода непосредственно связан с атомами фтора, кислорода и азота (иногда хлора и серы) обладают рядом аномальных свойств. У таких соединений аномально высокие вязкость, диэлектрическая проницаемость, температуры кипения и плавления.
Известно, что в ряду однотипных соединений данной подгруппы Тпл. и Ткип. с увеличением молярной массы возрастают.
56
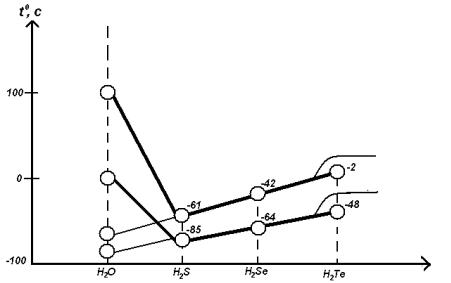
Рассмотрим ТПЛ. и Ткип. соединений элементов VI группы с водородом (H2O−H2S−H2Se−H2Te). Молярные массы этих соединений сверху вниз возрастают: H2O =18 ; H2S = 34 ; H2Se = 81; H2Te = 130.
Следовательно, ТПЛ. и ТКИП. у H2Te наибольшие, у H2Se – меньше, у H2S – ещё меньше, а у соединения H2O эти значения должны быть наименьшими.
Однако, как следует из рисунка 4.5, вода плавится и кипит при аномально высоких ТПЛ. и ТКИП. (температура кипения воды должна быть ~ − 90°С, а в действительности она + 100 °С).
Tкип.
Tпл.
мол. масса
Рис. 4.5. Температуры кипения и плавления соединений элементов VI группы с водородом.
Установлено, что эти и некоторые другие особенности указан-
ных соединений объясняются способностью атома водорода, соединённого с атомом сильно электроотрицательного элемента, к образованию ещё одной химической связи с другим подобным атомом другой молекулы. Такая связь называется водородной.
Возникновение водородной связи можно оценить в первом приближении действием электростатических сил.
Так, при образовании полярной связи между атомом водорода и атомом фтора, который характеризуется высокой электроотрицательностью, электронное облако, первоначально принадлежавшее атому водорода, сильно смещается к атому фтора. В результате атом фтора приобретает значительный отрицательный заряд, а ядро атома водорода (протон) с «внешней» по отношению к атому фтора стороны почти лишается электронного облака («оголяется»).
57

Между протоном атома водорода этой молекулы HF и отрицательно заряженным атомом фтора соседней молекулы HF возникает электростатическое притяжение, что и приводит к образованию водородной связи. Это обусловлено тем, что, обладая ничтожно малыми размерами (~ в 100000 раз меньше других ионов) и, в отличие от других катионов, не имея внутренних электронных слоёв, которые отталкиваются отрицательно заряженными атомами, ион водорода (протон) способен проникать в электронные оболочки других атомов.
Возникновение водородной связи можно объяснить и с помощью донорно-акцепторного механизма (см.схему).
1я молекула
 Электрон «стягивается» к атому F,
Электрон «стягивается» к атому F, 



 орбиталь «освобождается»
орбиталь «освобождается»
ДА – связь (на «свободную» орбиталь |
переходит неподелённая пара |
электронов 2й молекулы HF) |
2я молекула |
Водородную связь обычно обозначают точками (тремя), чтобы показать, что она значительно менее прочна, чем обычная ковалент-
ная связь (Евод.связи = 15…40 кДж/моль, Еков.связи = 125…420 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул,
т.е. объединение их в димеры (удвоение молекул), тримеры, тетрамеры и т.д.
Именно ассоциация молекул, затрудняющая их отрыв друг от друга, и служит причиной аномально высоких Тпл. и Ткип. таких веществ, как фторид водорода, аммиак, вода и др.
(Ведь чтобы закипела вода, необходимо дополнительно затратить энергию на разрушение ещё и водородных связей).
58
Характерно, что наиболее прочная водородная связь между молекулами HF, а наиболее высокая Ткип. у воды. Это объясняется наличием у H2O двух водородных связей, что придаёт димеру воды большую устойчивость.
Вструктуре льда каждая молекула H2O связана с четырьмя молекулами воды (тетрамеры).
Вжидкой воде при 20 ºC сохраняется только половина водородных связей (димеры).
Впарах воды нет водородных связей(мономеры).
Кстати, наличием водородных связей объясняется увеличение объёма воды при понижении температуры. Это связано с тем , что при понижении температуры происходит укрупнение молекул и поэтому уменьшается плотность их «упаковки».
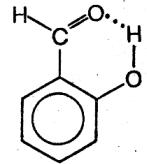
Водородная связь может быть не только межмолекулярной, но и внутримолекулярной. Например, в салициловом альдегиде происходит образование водородной связи между атомом водорода группы OH и атомами кислорода группы > C=0. Внутри − и межмолекулярные водородные связи существу-
ют в молекулах белков, ДНК и др.
Итак, рассмотренная водородная связь характерна лишь для атома водорода т.к. все другие атомы (не считая гелия He), имеют более одного элек-
тронного уровня и ядро их всегда экранировано.
4.9. Металлическая связь
Большинство элементов периодической системы – металлы (92 из 117). Металлы, несмотря на их большое разнообразие, имеют некоторые общие свойства:
-металлический блеск,
-высокая электро- и теплопроводность,
-пластичность, обусловливающая ковкость и тягучесть,
-восстановительная способность (легко отдают электроны).
Все эти свойства являются следствием проявления в металлах (твёрдых и жидких) металлической связи. Металлы имеют низкую энергию ионизации. На внешнем уровне их атомов мало электронов, но зато в избытке – свободные орбитали. Поэтому электроны одного атома могут переходить к другому атому и наоборот. Электроны не связаны с определёнными ионами и пребывают в поле то одного, то другого, взаимодействуя с ними.
59
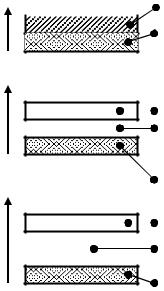
Эти делокализованные (или мигрирующие) электроны находятся на гигантских орбиталях, которые простираются по всей кристаллической решётке. Эти орбитали группируются по энергии в отдель-
ные зоны – валентную зону и зону проводимости (после того, как за-
полнена электронами одна зона, заполняется другая).
Валентная зона расположена ниже по энергии. Электроны в частично заполненной зоне проводимости могут легко перемещаться по всему кристаллу (рис. 4.6).
Е |
Металлы |
Зона проводимости (частично заполнена) |
|
|
|
|
|
Валентная зона (заполнена)
ЕПолупроводники
Зона проводимости (пустая)
Энергетическая щель (зазор) (При сообщении дополнительной
энергии электроны её «перескакивают»)
Валентная зона (заполнена)
Диэлектрики
Е(изоляторы)
Зона проводимости (пустая)
Запрещённая зона
Валентная зона (заполнена)
Рис.4.6. Зонная структура диэлектриков, полупроводников и металлов.
Вполупроводниках ширина запрещенной зоны ∆Е невелика (<400 кДж/моль). При поглощении энергии (квантов лучистой энергии при нагревании) электроны валентной зоны возбуждаются и переходят в зону проводимости и участвуют в переносе электрического тока.
С повышением температуры или при увеличении освещенности
число электронов, переходящих в зону проводимости, возрастает, а
значит, и увеличивается электропроводность полупроводника.
Визоляторах (диэлектриках) запрещенная зона ∆Е настолько велика (∆Е >400 кДж/моль), что препятствует переходу электронов из валентной зоны в зону проводимости. Для её преодоления требуется очень значительная энергия, при подведении которой кристалл либо расплавится, либо разрушится.
Химическая связь, осуществляемая в результате связывания катионов решётки свободными электронами, называется металли-
60
