
химия + методичка / theory
.pdf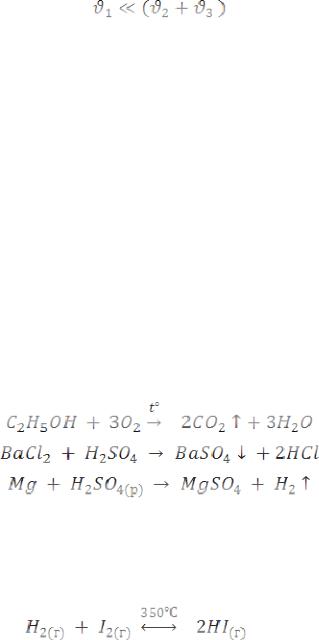
Мерой активности катализатора называется соотношение констант скоростей катализируемой и некатализируемой реакции:
A = |
Kкат. |
(5.26) |
|
Kнекат. |
|||
|
|
5.3.8. Химическое равновесие в гомогенных системах
Как отмечалось выше, химические реакции, в основном, подразделяются на обратимые и необратимые.
Необратимые реакции могут быть доведены или самопроиз-
вольно доходят до конца. Они заканчиваются тогда, когда полностью расходуется хотя бы один из исходных реагентов. Важнейшим условием необратимой реакции является образование нерастворимого, газообразного, либо малодиссоциированного продукта реакции (например, воды):
Большая часть химических реакций – обратимые.
Обратимыми называются реакции, протекающие при данных условиях одновременно в двух противоположных направлениях – прямом и обратном:
Реакцию, протекающую слева направо, называют прямой, а справа налево – обратной.
Как бы долго ни продолжалась указанная реакция, в реакционной смеси при 350°С будет сохранятся постоянный состав реагентов
(80% HI, 10% I2 и 10% H2).
Такое состояние возникает в результате установления химиче-
ского равновесия, характеризуемого одновременным протеканием прямой и обратной реакций с одинаковой скоростью.
Химическое равновесие является динамичным (подвижным), т.к. при его наступлении реакция не прекращается, неизменными остаются лишь концентрации компонентов. В состоянии равновесия за
101
единицу времени образуется такое же количество молекул продуктов реакции, какое превращается в исходные реагенты.
Рассмотрим реакцию общего вида:
ϑ1
mA + nB ↔ p C + qD
ϑ2
(m, n, p, q- стехиометрические коэффициенты)
υ
υ1
 υ 1 = υ 2
υ 1 = υ 2
 υ2
υ2
τ
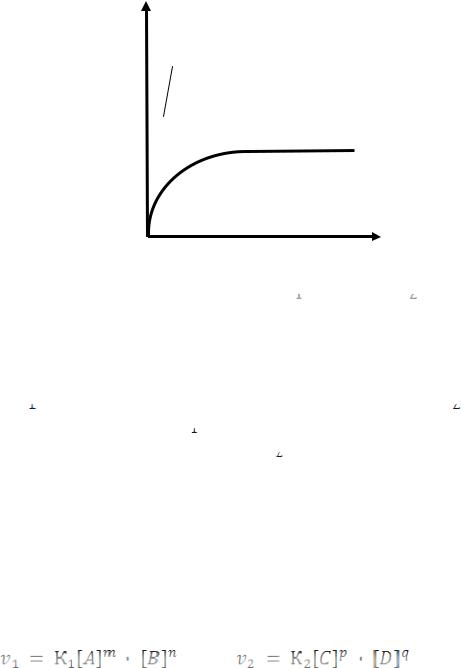
Рис.5.6 Изменение скоростей прямой (

 ) и обратной (
) и обратной (


 ) реакций в обратимых реакциях.
) реакций в обратимых реакциях.
В начальный момент (
 =0) , когда еще нет продуктов реакции, а концентрация исходных реагентов наибольшая, скорость прямой реакции (
=0) , когда еще нет продуктов реакции, а концентрация исходных реагентов наибольшая, скорость прямой реакции (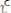

 ) максимальна, а скорость обратной реакции (
) максимальна, а скорость обратной реакции (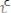


 ) равна нулю. С течением времени
) равна нулю. С течением времени 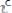

 снижается вследствие уменьшения концентрации исходных реагентов, а
снижается вследствие уменьшения концентрации исходных реагентов, а 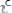


 возрастает, т.к. концентрация продуктов реакции возрастает.
возрастает, т.к. концентрация продуктов реакции возрастает.
Через некоторый промежуток времени скорости прямой и обратной реакций станут равными, что будет соответствовать установлению химического равновесия:
υ1 = υ2
Запишем выражение для υ1 и υ2 на основании закона действующих масс:
102
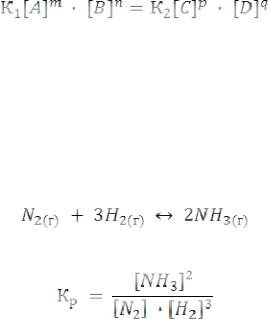
[А], [В] … - концентрации реагентов в состоянии равновесия
(равновесные концентрации). Тогда можем записать
Т.к. К1 и К2 – величины постоянные, то при неизменной температуре отношение K1/K2 будет величиной постоянной и выразится так:
K1 |
= Kp = |
[C]p ×[D]q |
(5.27) |
K2 |
[A]m ×[B]n |
Кp называется константой равновесия. Например, для реакции синтеза аммиака:
Выражение для Кp будет выглядеть так:
Кp не зависит от концентрации, но зависит от температуры, природы реагирующих веществ, наличия катализатора. (При подсчете Кp концентрации твердых и жидких веществ не учитываются).
Если Кp > 1 – преобладает прямая реакция, т.е. равновесие сдви-
нуто вправо.
Если Кp < 1 – преобладает обратная реакция, т.е. равновесие
сдвинуто влево.
5.3.9. Смещение химического равновесия. Принцип Ле Шателье
(1884 г)
Химическое равновесие при неизменных условиях может сохраняться сколь угодно долго. Оно является подвижным. Например, при изменении концентрации одного из реагирующих веществ концентрации всех других компонентов реакции также изменяются, но так, что константа равновесия остается неизменной.
Смещение химического равновесия, т.е. переход от одного равновесного состояния к другому, отвечающему измененным условиям, подчиняется правилу, называемому принципом Ле Шателье:
Если на систему, находящуюся в состоянии устойчивого химического равновесия, подействовать извне (т.е. изменить или температуру, или давление, или концентрацию), то равновесие смещается в сторону той реакции, которая препятствует произведенному воз-
103
действию (т.е. в системе возникают процессы, уменьшающие внешнее воздействие).
Рассмотрим влияние отдельных факторов на смещение равновесия на примере реакции синтеза аммимка:
N2( Г ) + 3H2( Г ) ↔ 2NH3( Г ) , H = −92кДж
а) Влияние изменения концентрации С (Р и Т =const).
Если в реакционной смеси увеличить концентрацию одного из реагирующих веществ, то в соответствии с принципом Ле Шателье равновесие сместится в направлении той реакции, при которой количество этого вещества уменьшается.
Так, при введении дополнительного количества одного из исходных реагентов (азота или водорода) равновесие реакции смещается вправо, т.е. в направлении уменьшения концентрации азота или водорода и образования большего количества аммиака (и наоборот).
Таким образом: Увеличение концентрации исходных реагентов смещает равновесие системы в сторону образования конечных про-
дуктов и наоборот, если увеличивать концентрацию конечных продуктов, то равновесие сместится влево, т.е. в сторону образования исходных реагентов (в сторону расходования конечных продуктов, т.е. уменьшения их концентрации).
б) Влияние изменения температуры Т (С и Р=const).
Рассматриваемая реакция – экзотермическая, т.е. идет с выделением тепла (∆Н = –92кДж).
В соответствии с принципом Ле Шателье, при повышении температуры равновесие этой реакции смещается влево, т.е. в направлении реакции, идущей с поглощением тепла (эндотермической реакции), и поэтому ослабляется внешнее воздействие – повышение температуры. Наоборот, охлаждение реакционной смеси (понижение температуры) смещает равновесие вправо, т.е. в сторону реакции, идущей с выделением тепла и поэтому противодействующей охлаждению.
Таким образом: При повышении температуры равновесие смещается в сторону эндотермической реакции, а при понижении – в сторону экзотермической реакции.
в) Влияние изменения давления (С и Т = const).
Давление влияет на равновесие реакций, в которых участвуют
газообразные и парообразные вещества.
104
Синтез аммиака сопровождается уменьшением объема: из четырех молекул исходных реагентов образуются две молекулы аммиака. Очевидно, что в закрытом сосуде при постоянной температуре продукт этой реакции (NH3) создает меньшее давление, чем исходные реагенты.
Значит, прямая реакция – синтез аммиака – сопровождается уменьшением давления. Наоборот, разложение аммиака на водород и азот ведет к увеличению числа молекул, а поэтому и к увеличению давления.
При сжатии реакционной смеси (увеличении давления) равнове-
сие смещается вправо, т.е. в сторону образования аммиака, т.к. этот процесс приводит к уменьшению давления, и, следовательно, противодействует внешнему воздействию. Наоборот, уменьшение давления смещает равновесие влево, т.е. в направлении разложения аммиака, т.к. эта реакция идет с увеличением давления.
Таким образом: При увеличении давления путем сжатия системы равновесие смещается в сторону уменьшения числа молекул газа (или пара), т.е. в сторону понижения давления и наоборот, при уменьшении давления равновесие сдвигается в сторону реакции, идущей с увеличением давления.
Из сказанного выше можно сделать ряд практических выводов. В целях получения как можно больших количеств аммиака, его синтез необходимо проводить при возможно более низкой температуре и более высоком давлении. Применяя избыток одного из исходных веществ (N2 или Н2) можно добиться более полного превращения исходных реагентов в продукт реакции.
Если реакция протекает без изменения числа молекул газообразных или парообразных веществ, то изменение давления не влияет на равновесие в данной системе, например:
Следует также отметить, что введение катализатора не вызывает смещения равновесия, т.к. катализатор в одинаковой мере ускоряет как прямую, так и обратную реакцию. Однако его присутствие в системе значительно сокращает время, необходимое для установления химического равновесия.
Таким образом, применение принципа Ле Шателье к обратимым химическим реакциям открывают путь к управлению химическими процессами.
105
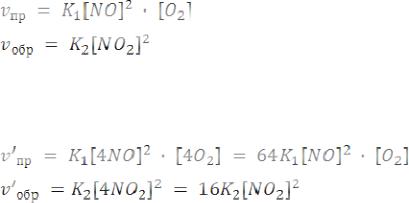
Пример. Как изменится скорость прямой реакции по сравнению со скоростью обратной реакции:
ϑ1
2NO( Г ) + O2 « 2NO2( Г )
ϑ2
протекающей в закрытом сосуде, если увеличить давление в четыре раза? Куда сместится равновесие? Ответы подтвердить расчетом.
До увеличения давления:
После увеличения давления:
Увеличение давления в четыре раза в закрытом сосуде приводит к увеличению в четыре раза концентрации реагентов, значит:
Ответ: Равновесие сместится вправо, т.к. скорость прямой реакции увеличилась в 64 раза, а обратной – всего лишь в 16 раз.
ГЛАВА 6. ДИСПЕРСНЫЕ СИСТЕМЫ 6.1. Классификация дисперсных систем
Дисперсными называются системы, содержащие две (или более) фазы, равномерно распределенные друг в друге. (“Дисперсный” – значит “раздробленный, рассеянный”)
Совокупность дисперсных частиц называют дисперсной фазой. Фаза, в которой распределены частицы, называется дисперсионной средой.
Свойства дисперсной системы определяются размерами частиц дисперсной фазы, т.е. степенью дисперсности (D).
D = |
1 |
(6.1) |
|
2 ×r |
|||
|
|
где r – радиус частиц.
С повышением степени дисперсности все большая и большая доля атомов вещества находится в поверхностном слое на границе раздела фаз, по сравнению с их числом внутри объема дисперсной фазы.
106
|
|
|
Таблица 6.1 |
|
|
Виды дисперсных систем |
|||
|
|
|
|
|
Дисперсионная |
Дисперсная |
Условные |
Пример системы |
|
среда |
фаза |
обозначения |
||
|
||||
|
газ |
г/г |
Воздух |
|
Газ |
жидкость |
ж/г |
аэрозоли |
|
|
тв. тело |
т/г |
||
|
|
|||
|
газ |
г/ж |
Пена |
|
Жидкость |
жидкость |
ж/ж |
Эмульсия (молоко) |
|
|
тв. тело |
т/ж |
Суспензия глины в воде. |
|
|
Газ |
г/т |
Тв. пены (пемза) |
|
Твердое тело |
Жидкость |
ж/т |
Тв. эмульсии (жемчуг = |
|
|
|
=CaCO3 + H2O) |
||
|
тв. тело |
т/т |
||
|
Сплавы |
|||
|
|
|
|
|
Если, например, взять кубик с длиной ребра 1 см, то его суммарная поверхность равна S =6 см2. Если раздробим его до размера ребра 10-4 см, то S =6 м2, а если раздробить его до размера 10-6 см (размер коллоидных частиц), то суммарная площадь будет 600 м2! (Так, 1г активированного угля имеет поверхность ~1000 м2).
По степени дисперсности все дисперсные системы разделяются на три группы: истинные растворы, коллоидные растворы и грубодисперсные растворы.
I. Истинные растворы (подробно будут рассмотрены ниже) –
дисперсная фаза находится в виде молекул или ионов, т.е. r  0,001 мкм.
0,001 мкм.
II. Коллоидные растворы (“золи”) – в них дисперсная фаза находится в виде агрегатов молекул, r = 0,001...0,1 мкм.
Для приготовления коллоидных растворов следует получить частицы указанных размеров, подобрать дисперсионную среду, в которой не растворяется вещество частиц, и обеспечить устойчивость частиц. В качестве вещества коллоидных частиц в водных средах служат металлы, оксиды, гидроксиды, сульфиды и др.
Частицы соответствующих размеров получают следующими способами:
1)Дисперсионными – основаны на механическом раздроблении исходного вещества, например, в коллоидных мельницах (естественные “коллоидные мельницы” – горные реки).
2)Конденсационными:
107
а) Соединения более мелких частиц. Например, гидрозоли металлов (Au, Ag, Pt) получают, создавая электрическую дугу в воде. Металл испаряется, затем пары его конденсируются, образуя коллоидные частицы металла.
б) Химические методы. Существует много реакций, продукты которых выделяются в коллоидной степени дисперсности (при определенных условиях).
AgNO3 + HCl = AgCl ↓ +HNO3
FeCl3 + 3H2O = Fe(OH )3 ↓ +3HCl
Na2S2O3 + 2HCl = S ↓ +2NaCl + H2O + SO2
Для повышения устойчивости коллоидов в раствор вводят стабилизаторы, например, поверхностно-активные вещества (ПАВ).
В природе идут естественные процессы образования коллоидных растворов при взаимодействии воды с глиной, органическими (напр., гумусными) кислотами и другими веществами. Природные воды, особенно в период половодья, содержат заметное количество веществ в коллоидном состоянии.
Коллоидные частицы в коллоидных растворах (“золях”) находятся в непрерывном беспорядочном (“броуновском”) движении. Во взвешенном состоянии они могут находиться очень долгое время, не осаждаясь. Причина устойчивости коллоидных растворов – в одноименной заряженности коллоидных частиц.
Если в коллоидный раствор опустить электроды, то коллоидные частицы начинают медленно передвигаться к определенному электроду, что и доказывает их заряженность.(“+”→ “–“ или “–“→“+”)
Этот электрический перенос частиц называется электрофорезом (например, покрытие металлов полимерами).
“+” заряд – органические краски, частицы гидроксидов металлов
и др.
“–” заряд – сера, сульфиды, крахмал и др.
Происхождение зарядов объясняется адсорбцией коллоидными частицами определенных ионов из раствора.
Отдельная частица коллоидной системы называется мицеллой. Рассмотрим мицеллу Fe(OH)3, полученную гидролизом FeCl3 в
кипящей воде.
FeCl3 + 3H2O = Fe(OH )3 ↓ +3HCl
108
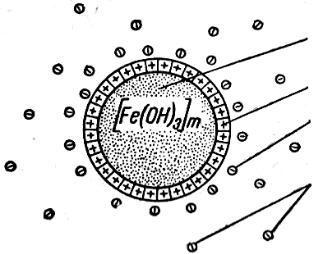
Ядро мицеллы (см. рис.6.1) – [Fe(OH)3]m – состоит из сотен тысяч молекул – оно обладает большой поверхностью. Ядро адсорбирует из раствора ионы Fe3+, находящиеся в нем в избытке. Ионы, адсорбированные на ядре мицеллы, определяют заряд коллоидных частиц
[Fe(OH)3]m ∙nFe3+
1
2
3
4
Рис. 6.1. Строение мицеллы: 1 – ядро коллоидной частицы ([Fe(OH)3]m); 2 – адсорбированные ядром ионы Fe3+; 3 – противоионы Cl- , адсорбированные ядром; 4 –
противоионы диффузионного слоя.
Если адсорбиловалось “n” ионов железа, то в растворе находится “3n” ионов хлора (заряд одного иона Fe3+ равен заряду трех ионов Cl-). Ионы хлора называются противоионами.
Гидратированные ионы хлора в жидкой фазе находятся под действием двух противоположных сил:
а) Электростатического притяжения к ионам Fe3+; б) Диффузионных, стремящихся их рассеять.
В результате совместного действия этих сил часть (меньшая) противоионов более или менее прочно связываются с адсорбированными на ядре ионами Fe3+.
Образуется адсорбционный слой противоионов. Эту часть ионов хлора обозначим X. Остальные 3n-X ионов хлора образуют диффузионный слой противоионов – ионную атмосферу мицеллы. Это свободные противоионы.
Ионы диффузионного слоя непрерывно обмениваются с одноименными ионами адсорбционного слоя, т.е. устанавливается под-
вижное равновесие.
Прочный комплекс – ядро + адсорбционный слой называется
гранулой.
109
{mFe(OH )3 × nFe3+ × xCl−}(3n−x)+ (3n - x)Cl−
гранула
коллоидная мицелла
При электрофорезе гранула перемещается как нечто целое.
III. Грубодисперсные системы (суспензии, пены, эмульсии) – в них дисперсная фаза находится в виде частиц размером > 0,1 мкм.
Эмульсии состоят из двух практически нерастворимых жидких фаз, одна из которых распределена в другой в виде мельчайших капелек (например, молоко – эмульсия жира в воде + казеин + растворенный молочный сахар). Обычно капельки имеют размер от 0,1 до 50 мкм и их можно наблюдать в обычный микроскоп.
Как правило, эмульсии получают диспергированием (дроблением) одной жидкости в другой. Для устойчивости добавляют эмульгаторы (стабилизаторы), как правило, это ПАВ.
К концентрированным эмульсиям очень близки пены.
Пены – это дисперсные системы, состоящие из ячеек, заполненных газом (воздух, СО2 и др.) и отделенных друг от друга жидкими или твердыми пленками очень малой толщины. Устойчивость пен зависит лишь от прочности их пленочного каркаса. Пены с твердыми стенками (напр., пенопласты), обычно очень устойчивы и могут существовать практически неограниченное время. Пены с жидкими пленками, как правило, неустойчивы.
Суспензии – это дисперсные системы, представляющие собой взвеси твердых частиц в жидкостях. Концентрированные системы иногда называют пастами. Суспензии, у которых размер частиц не превышает 1мкм, называют высокодисперсными. Дисперсную фазу суспензий отделяют фильтрованием или отстаиванием.
В виде суспензий применяют многие строительные материалы (цемент), лаки и краски, адсорбенты, латексы (суспензии каучука и других полимеров в водных растворах) и др. Суспензии чаще всего получают механическим диспергированием.
6.2. Устойчивость дисперсных систем
Дисперсные системы могут существовать, не разрушаясь, длительное время. Различают кинетическую и агрегативную устойчивость.
110
