
химия + методичка / theory
.pdfВ водных растворах некоторые электролиты полностью распадаются на ионы, другие же распадаются лишь частично, часть их молекул остаётся в растворе в недиссоциированном виде. Степень диссоциации (α) определяется соотношением:
α = число диссоциированных молекул ×100%
;
общее чило растворенных молекул
“α” зависит от природы электролита и растворителя, а также от концентрации и температуры раствора.
При уменьшении концентрации электролита, т.е. при разбавлении раствора “α” увеличивается, т.к. увеличивается расстояние между ионами в растворе и уменьшается возможность соединения их в молекулы.
При увеличении температуры “α”, как правило, увеличивается. В зависимости от степени диссоциации электролиты делятся на
сильные и слабые.
Сильные электролиты – это такие электролиты, которые в вод-
ных растворах полностью диссоциируют на ионы, т.е. их степень диссоциации “α” равна 1 (100%).
Ксильным электролитам относятся:
1.Почти все соли;
2.Сильные кислоты (НCl, HBr, HI, H2SO4, HNO3 и др.);
3.Щёлочи (KOH, NaOH, Ca(OH)2 и другие гидроксиды ще-
лочных и щёлочно-земельных металлов).
Процесс диссоциации сильных электролитов является необратимым, например:
NaNO3→Na++NO3-
H2SO4 →2H++SO42-
KOH→K++OH-
Сильные электролиты в водных растворах находятся только в виде ионов. Электростатическое взаимодействие между ионами ос-
131
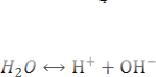
лабляется до минимума из-за большого расстояния между ними и наличия гидратных оболочек, играющих экранирующую роль.
Слабые электролиты – это такие электролиты, которые в вод-
ных растворах диссоциируют на ионы не полностью, т.е. их степень диссоциации “α” меньше 1 (<100%).
К слабым электролитам относятся:
1.Слабые кислоты (H2SO3, Н2СО3, Н2S, HCN и д.р.), а также практически все органические кислоты;
2.Слабые нерастворимые в воде основания (кроме щелочей) – Fe(OH)2, Сu(OH)2, NH4OH и др.;
3.Соли, малорастворимые в воде;
4.Вода.
Диссоциация слабых электролитов – процесс обратимый, поэтому в уравнениях их диссоциации используют знак обратимости.
НCN H++CN-
NH4OH 











Между изотоническим коэффициентом “i” и степенью диссоциации “α” существует соотношение:
α = |
i −1 |
|
×100% |
(7.23) |
|
n -1 |
|||||
|
|
|
|||
где: n – число ионов, на которые диссоциирует молекула растворённого электролита:
NaCl→Na++Cl- (n=2)
CaCl2→Ca2++2Cl- (n=3)
Al2(SO4)→2Al3++3SO4 2- (n=5)
7.9. Константа диссоциации слабых электролитов
132

К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение для константы равно-
весия, которую называют константой диссоциации (Кд).
НCN H++CN-
Kд = [H[+ ]×[CH] − ]. HCN
“Кд” зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации раствора.
Связь между “α” и “Кд” электролита, распадающегося на два иона, определяется законом разведения Оствальда:
α = |
|
Kд |
|
(7.24) |
|
c |
|||||
|
|
||||
|
|
|
|
где: с – концентрация электролита.
Чем выше Кд, тем легче электролит диссоциирует.
Например:
Kд (CH COOH ) = [CH[ 3COO− ]×[H] + ]=1,8×10−5 3 CH3COOH
Kд (HCN ) = [H[+ ]×[CN] − ]= 8×10−10
HCN
Следовательно, уксусная кислота СН3СООН – более сильный электролит, чем цианистоводородная кислота НСN.
Kд(CH3COOH ) > Kд(HCN )
Многоосновные кислоты и основания двух- и более валентных металлов диссоциируют ступенчато.
|
H CO ↔ H + + HCO − |
|
Kд1 = |
[H + ]×[HCO − ] |
|
||||
1. |
; |
|
|
3 |
|
; |
|||
[H CO ] |
|
|
|||||||
2 3 |
3 |
|
|
|
|||||
|
|
|
|
|
2 |
3 |
|
|
|
133

− |
|
|
+ |
|
2− |
|
|
[H + ]×[CO 2− ] |
||
|
|
|
|
|
|
|
|
3 |
|
|
2. HCO3 ↔ H |
|
+ CO3 |
|
; Kд2 = |
[HCO− ] |
; |
||||
(всегда Кд1>> Кд2) |
|
|
|
3 |
|
|||||
|
+ + CO 2− |
|||||||||
Суммарно: |
H |
CO ↔ 2H |
||||||||
2 |
|
|
3 |
|
|
3 |
|
|
||
|
Kд = |
[H + ]2 ×[CO 2− ] |
|
|
||||||
|
|
3 |
|
или: Kд = Kд1 × Kд2 |
||||||
|
[H |
CO ] |
||||||||
|
|
|
|
|
|
2 |
3 |
|
|
|
7.10. Ионные реакции и равновесия
Так как молекулы электролитов в растворах распадаются на ионы, то и реакции в растворах электролитов протекают между ионами.
Реакции, протекающие между ионами, называются ионными. Поэтому их выражают не в молекулярных уравнениях, а в виде так называемых ионных уравнений.
Необходимым условием протекания реакций в растворах электролитов является связывание тех или иных ионов. С участием ионов могут протекать как обменные, так и окислительно-восстановитель- ные реакции.
Вионообменных реакциях в растворах равновесие смещается в сторону образования наименее диссоциированных соединений. В та-
ких реакциях не происходит изменения зарядов ионов, входящих в соединения.
Вуравнениях ионных реакций формулы сильных электролитов записывают в диссоциированном виде, а слабых – в недиссоциированном, т.е:
Ввиде ионов записывают формулы:
-сильных кислот (H2SO4, HNO3, HCl и др.);
-сильных оснований (щелочей – KOH, Cа(OH)2 и др.);
-растворимых в воде солей (NaCl, KNO3 и др.).
В виде молекул записывают формулы:
-воды H2O;
-слабых кислот (HCN, H2S, H2SO3 и.др.);
-слабых оснований (NH4OH, Cu(OH)2, Fe(OH)3 и др.);
-малорастворимых солей (↓), AgCl, BaSO4, CaCO3, FeS и др.);
-амфотерных гидроксидов (↓), Al(OH)3, Zn(OH)2, Cr(OH)3 и др.).
Большая часть молекул слабых электролитов в растворе не дис-
социирует на ионы.
134
Рассмотрим условия протекания реакций обмена в растворах электролитов.
Первое условие: связывание тех или иных ионов в молекулы труднорастворимых соединений (осадков), т.е. ионные реакции протекают в сторону образования осадков (труднорастворимых веществ).
NaCl+AgNO3=AgCl↓+NaNO3
полное ионное уравнение: Na++Cl-+Ag++NO3-=AgCl↓+Na++NO3-
Ионы Na+ и NO3- не взаимодействуют друг с другом (т.к. NaNO3
– сильный электролит), поэтому в ионное уравнение их не пишут. Реакция протекает лишь между ионами Ag+ и Cl-, что и изобра-
жают сокращенным ионным уравнением: Ag++Cl- = AgCl↓
Второе условие: связывание ионов в молекулы газообразных веществ, т.е. ионные реакции протекают в сторону образования газов.
Na2S+2HCl=2NaCl+H2S↑
Полное ионное уравнение:
2Na++S2-+2H++2Cl- = 2Na++2Cl-+H2S↑
Сокращённое ионное уравнение: S2-+2H+=H2S↑
Третье условие: образование слабодиссоциирующих соединений (воды, слабой кислоты, слабого основания), т.е. ионные реакции протекают в сторону образования слабодиссоциирующих соединений.
а) Образование воды (нейтрализация сильной кислоты сильным основанием):
NaOH+HCl=NaCl+H2O
Na++OH-+H++Cl- = Na++Cl-+H2O
Т.к. NaCl – сильный электролит, то ионы Na+ и Cl- не взаимо-
действуют друг с другом, а взаимодействуют только ионы Н+ и ОН- : H+ + OH- = H2O
б) Образование слабого основания: NH4Cl+KOH=NH4OH+KCl
NH4+ + Cl- +K++OH- = NH4OH+K++Cl-
135

NH4+ +OH- = NH4OH
объяснение то же.
в) Образование слабой кислоты
2СН3СOONa+H2SO4 = 2CH3COOH+Na2SO4
(ацетат натрия)
2СН3СOO-+2Na++2H+ + SO42- = 2CH3COOH+2Na+ + SO42-
СН3СOO-+H+ = CH3COOH
Если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми,
т.е. до конца не протекают:
СН3СOOH + NaOH ↔ CH3COONa+H2O
(слабый электролит) |
(слабый электролит) |
Cu(OH)2 + 2HCl ↔ CuCl2 + 2H2O |
|
(нерастворимое основание) |
(слабый электролит) |
7.11. Диссоциация воды. Водородный показатель
Чистая вода очень плохо проводит электрический ток, но всё же обладает измеримой электропроводностью, которая объясняется незначительной диссоциацией воды:
H2O↔ H+ + OH- ; α=1,8·10-9 (при 22 °С)
т.е. диссоциировано 18г (1 моль) молекул воды (6,02∙1023) в 100 миллионах литров её (из 555 000 000 молекул воды диссоциирована только одна).
Запишем уравнение для константы диссоциации воды:
Kд = [H +[]×[OH] − ]=1,8×10−16 ;
H2O
т.к. степень диссоциации очень мала, поэтому величину [H2O] можно считать постоянной. Отсюда: [H+]∙[ОH-]=[H2O]∙1,8·10-16.
Молярная концентрация воды (т.е. концентрация молекул воды в 1л.):
[H2O]= 1000/18 = 55,56 моль/ л 1
тогда: [H+]∙[ОH-]=1,8∙10-16∙55,56=1,0∙10-14 – это величина постоянная не только для воды, но и для водных растворов (при t=22°C).
136

Эту величину называют ионным произведением воды и обозначают KH2O :
KH 2O = [H + ]×[OH − ] = 1,0 ×10−14 моль / л |
(7.25) |
Поскольку диссоциация воды – эндотермический процесс (∆H=57,5 кДж/моль), то в соответствии с принципом Ле Шателье, при повышении температуры воды диссоциация её усиливается, и вели-
чина KH 2O возрастает:
t, °С |
0°С |
22°С |
100°С |
K H 2 O |
0,11·10-14 |
1·10-14 |
59·10-14 |
При диссоциации одной молекулы воды получается один ион Н+ и один ион ОН-, поэтому:
[H + ] = [OH − ] = 
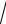 10−14 = 10−7 моль / л .
10−14 = 10−7 моль / л .
Если:
[H + ] = [OH − ] – раствор нейтральный;
[H + ] > [OH − ] – раствор кислый ([H + ] > 10−7 моль / л ); [OH − ] > [H + ] – раствор щелочной ([OH − ] > 10−7 моль / л ).
Например: Если концентрация [H + ] = 10−3 моль / л , концентрация [OH − ] будет равна:
Из (7.25) определим:
|
KH O |
|
10−14 |
|
||||
[OH − ] = |
|
2 |
= |
|
|
|
= 10−11 |
; |
[H |
+ |
10 |
−3 |
|||||
|
] |
|
|
|
|
|||













 , значит, раствор имеет кислую реакцию.
, значит, раствор имеет кислую реакцию.
Водородный показатель pH (читается ПЭ-АШ).
Кислотность или щёлочность выражают другим, более удобным спо-
собом: Вместо концентрации ионов водорода указывают её десятичный логарифм, взятый с обратным знаком. Эту величину назы-
вают водородным показателем pH.
pH = - lg[H+ ] |
(7.26) |
так, если [H+]=10-3 моль/л, то pH= – lg10-3= – (–3)=3;
следовательно:
pH=7 – нейтральная среда;
137
pH<7 – кислая среда; pH>7 – щелочная среда.
Удобно сопоставлять состояние среды в виде схемы:
pH→0 1 2 3 4 5 6 |
7 |
8 9 10 11 12 13 14 |
|
|||
|
|
|
|
|
|
|
|
Кислая среда |
|
|
|
Щелочная среда |
|
Ней- |
|
|
||||
|
Усиление |
тральная |
|
Усиление щёлочности |
||
|
среда |
|
||||
|
кислотности |
|
|
|
||
|
|
|
|
|
||
Крайние значения этой схемы соответствуют ≈1н. HCl (pH≈0) и ≈1н. NaOH (pH≈14). Значение pH может быть больше 14 и быть отрицательным (очень кислая среда).
Величина “pH” имеет большое значение в химических и биологических процессах, т.к. в зависимости от характера среды эти процессы могут протекать с разными скоростями и в разных направлениях. Поэтому определение “pH” растворов очень важно в медицине, науке, технике, сельском хозяйстве. Изменение “pH” крови или желудочного сока является диагностическим тестом в медицине. Отклонение “pH” от нормальных величин даже на 0,01 единицы свидетельствует о патологических процессах в организме. Постоянство концен-
трация ионов Н+ является одной из важных констант внутренней среды живых организмов.
Так, при нормальной кислотности желудочный сок имеет pH=1,7; pH крови человека равен 7,4; слюны 6,9.
Для качественного определения “pH” на практике применяют индикаторы – вещества, окраска которых меняется при изменении “pH” раствора. Наиболее распространенные индикаторы:
Лакмус – в интервале “pH” от 5,0 до 8,0 приобретает фиолетовый цвет.
Метилоранж – в интервале “pH” от 3,0 до 4,4 – оранжевый
цвет.
Фенолфталеин – в интервале “pH” от 8,2 до 10 – розовый цвет. Кроме указанных выше индикаторов, применяют так же универ-
сальный индикатор, который можно использовать для приблизительного определения “pH” в широком интервале от 0 до 14 с точностью до
0,1.
138

В настоящее время разработаны способы определения “pH” растворов инструментальными методами (pH-метры, на основе измерения ЭДС).
7.12. Гидролиз солей
Водные растворы солей имеют различные значения “pH”, т.е. показывают различную реакцию среды – кислую, щелочную или нейтральную. Например, водный раствор AlCl3 – кислая среда (pH<7), раствор карбоната натрия Na2CO3 – щелочная среда (pH>7), раствор NaCl – нейтральная среда (pH=7).
Все эти соли не содержат в своём составе ионов водорода Н+
или гидроксид-ионов ОН-, которые определяют реакцию среды. Чем же можно объяснить различные среды водных растворов солей?
Это объясняется тем, что в водных растворах многие соли подвергаются гидролизу. Слово «гидролиз» означает «разложение во-
дой».
Гидролиз – это химическое взаимодействие ионов соли с ионами воды, сопровождающееся изменением концентраций последних, и в результате которого образуются слабые электролиты (малодиссциирующие соединения).
При этом химическое равновесие процесса диссоциации воды смещается вправо:
Н2О Н+ + ОН-
Поэтому в водном растворе соли появляется избыток или сво-
бодных ионов Н+, или ОН- , и раствор соли показывает либо кислую, либо щелочную реакцию.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль КСN образована слабой кислотой НСN и сильным основанием КОН:
HCN+KOH=KCN+H2O
В зависимости от силы исходной кислоты и исходного основания все соли можно разделить на четыре типа:
Кислоты
139
Основания |
Сильные |
Слабые |
|
|
|
Сильные |
NaCl |
CH3COONa |
Слабые |
NH4Cl |
CH3COONH4 |
1.Соль сильной кислоты и сильного основания.
Втаких солях, например NaCl, ионы Na+ и Cl- не соединяются с молекулами воды:
NaCl+H2O≠
Поэтому равновесие системы: H2O H++OH-
не нарушается, т.е. раствор соли остаётся нейтральным
(pH=7), [Н+]=[ОН-]
Допустим, что при взаимодействии NaCl с водой происходила бы реакция гидролиза с образованием кислоты и основания:
NaCl+H2O NaOH+HCl
Запишем уравнение в ионном виде, учитывая, что единственным слабодиссоциирующем соединением в этой системе является вода:
Na++Cl-+H2O Na++OH-+H++Cl-
После сокращения одинаковых ионов в обеих частях уравнения
остаётся уравнение диссоциации воды: Н2О Н++ОН-
140
