
химия + методичка / theory
.pdf
|
|
|
|
|
|
|
ē |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ē |
– |
|
|
|
+ |
|
ē |
|
|
|
|
|||||||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
К(–) |
|
|
|
|
|
|
|
A(+) |
|
+ Na+ |
Cl – – |
NaCl → Na+ + Cl− |
Рис. 9.2. Электролиз расплава NaCl. |
Катионы Na+ под действием электрического поля движутся к катоду, принимают от него электроны и восстанавливаются:
(−)K : Na+ + e = Na0
Анионы Cl– движутся к аноду, отдают ему электроны и окисляются:
(+)A : 2Cl − − 2e = Cl2 −
Суммарное уравнение процесса электролиза:
2NaCl ¾эл¾. ток¾® 2Na + Cl2 - .
Процессы, протекающие на электродах при электролизе: На (–) катоде:
1. Восстановление катионов электролита до нейтральных атомов и молекул:
Ni2+ + 2e = Ni0
2H + + 2e = H2 −
2.Восстановление молекул воды:
2H2O + 2e = H2 − +2OH −
На (+) аноде:
161

1.Окисление (растворение) металла анода:
Cu0 − 2e = Cu2+ |
(Cr, Ni, Cd, Zn и др.). |
В этом случае электрод называется растворимым.
Если же анод служит лишь проводником электронов, его назы-
вают нерастворимым (золото, платина, графит, токопроводящая пластмасса и др.) и на нем происходит:
2.Окисление (разряд) анионов растворённого электролита:
2Br− − 2e = Br2.
4OH − − 4e = 2H2O + O2 − (в щелочных растворах).
3.Окисление молекул воды:
2H2O − 4e = O2 − +4H +.
9.1. Законы Фарадея
Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит электричества выражается двумя законами Фарадея:
1. Массы веществ, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и не зависят от других факторов:
m = kэ ×Q или m = kэ × I ×t , |
(9.1) |
где kэ – электрохимический эквивалент. Он равен массе вещества, выделяющейся при прохождении 1 Кулона электричества.
2. При пропускании одинакового количества электричества через растворы или расплавы различных электролитов массы веществ, выделяющихся на электродах, пропорциональны молярным массам их эквивалентов:
m1 |
= |
m2 |
= ... |
mn |
(9.2) |
|
mэ |
mэ |
|||
mэ |
|
|
|||
1 |
|
2 |
|
n |
|
Для выделения на электроде одной молярной массы эквивалента (mэ) необходимо затратить одно и то же количество электричества, а именно 96500 Кулонов, называемое числом (коэффициентом) Фарадея ( F). Число Фарадея равно произведению числа Авогадро на заряд электрона: F = NA × e = 6,02 ×1023 ×1,6 ×10−19 Кл = 96500Кл.
162
Например, для выделения 1г водорода (mэ=1 г/моль), или 8г кислорода (mэ=8 г/моль), или 32 г меди (mэ=64/2= 32 г/моль), или 66г золота (mэ =197/3=66 г/моль) требуется затратить одно и то же коли-
чество электричества, а именно 96500 Кл.
Следовательно, можно записать выражение для электрохимического эквивалента kЭ:
kэ = |
mэ |
= |
mэ |
(9.3) |
|
96500 |
|||
|
F |
|
||
Отсюда выражение (9.1) можно записать в окончательном виде:
m = mэ × I ×t |
, г |
, |
(9.4) |
96500 |
|
|
|
где m – масса выделившегося вещества, г; mэ – молярная масса эквивалента выделившегося вещества, г/ моль; I – сила тока, А; t – продолжительность электролиза (в секундах!).
Если на электродах выделяются газообразные вещества, то объем выделившегося газа рассчитывается по формуле:
V = Vэ×I ×t |
, |
|
0 |
96500 |
(9.5) |
где: V0 – объем выделившегося газа, л. Vэ – эквивалентный объем газа (напомним, что для кислорода Vэ=5,6 л; для водорода и хлора
Vэ=11,2 л).
Одним из показателей эффективности использования электроэнергии в процессах электролиза является выход по току (КПД электролиза):
η = |
mф |
×100% |
(9.6) |
|
|||
|
m |
|
|
где: mф – фактически выделившаяся масса вещества на электроде; m – теоретически возможная, рассчитанная по уравнению (9.4).
9.2. Электролиз растворов с нерастворимыми электродами
Особенностью электролиза растворов является наличие в них наряду с ионами электролита молекул воды, которые также участвуют в процессах, протекающих на электродах (см. выше).
Для определения порядка протекания этих процессов следует руководствоваться следующими практическими правилами:
163
Процессы на (–) Катоде: (не зависят от материала катода, а зависят от положения металлов в ряду напряжений).
Все металлы в ряду напряжений условно делятся на три группы:
-активные металлы (Li – Al включительно);
-металлы средней активности (от Al до H2);
-малоактивные металлы (от H2 до Au).
1) Катионы активных металлов из водных растворов не вос-
станавливаются, вместо них восстанавливаются молекулы воды:
2H2O + 2e = H2 − +2OH −
2) Катионы металлов средней активности восстанавливаются одновременно с молекулами воды, например:
ìZn2+ + 2e = Zn0
íî2H2O + 2e = H2 - +2OH −
( т.е. протекают параллельно оба процесса).
3) Катионы малоактивных металлов восстанавливаются в пер-
вую очередь, например:
Ag+ + e = Ag0
4) Если в растворе находится смесь катионов различных металлов, то первыми восстанавливаются катионы того металла, который имеет наибольшее алгебраическое значение электродного потенциала.
Например, в растворе находятся катионы Zn2+, Cu2+, Pb2+ (к при-
меру, ZnSO4+Cu SO4+Pb SO4).
Их восстановление будет происходить в следующей последовательности:
Cu2+ + 2e = Cu0
Pb2+ + 2e = Pb0
Zn2 + 2e = Zn0
Процессы на (+) Аноде:
1. В первую очередь окисляются анионы бескислородных кислот
(Cl-, Br-, I-, S2-, CN- и др., кроме F-) т.к. приобретённые ими электроны удерживаются слабее, чем в молекулах воды:
2Cl- – 2ē = Cl2↑.
2. Анионы кислородсодержащих кислот ( NO3− , SO42− , PO43− и др.) и
фториды не окисляются, а идёт процесс окисления воды. Это объяс-
164
няется тем, что в анионах этих кислот электроны связаны прочнее, чем в молекулах воды:
2H2O – 4ē=O2↑+4H+.
3. В щелочных растворах окисляются ионы OH− :
4OH- – 4ē=2H2O+O2↑.
Примеры:
KNO3
↓
(−)K H 2O← K+ + NO3− →H 2O (+)A
(-)K : 2H2O + 2e = H2 - +2OH − (+)A : 2H2O - 4e = O2 - +4H +
NiSO4
¯
(-)KH2O ¬ Ni2+ + SO42− ®H2O (+)A
(+)A : 2H2O - 4e = O2 - +4H +
(-)K : ìNi2+ + 2e = Ni0 −
îí2H2O + 2e = H2 - +2OH
CuCl2
¯
(-)KH2O ¬ Cu2+ + 2Cl− ®H2O (+)A (-)K : Cu2+ + 2e = Cu0
(+)A : 2Cl− - 2e = Cl2 -
9.3. Электролиз растворов с растворимым анодом
При электролизе растворов с растворимым анодом источником электронов во внешнюю цепь является не разряд анионов электролита (как при нерастворимом аноде), а главным образом окисление самого металла анода, который при этом растворяется – катионы Men+ переходят в раствор.
Дальнейшее состояние этих катионов может быть двояким:
а) В растворе электролита имеются анионы, способные давать с данными катионами нерастворимые соединения. В этом случае катионы выпадают в осадок.
165
Например, электролиз раствора NaCl с железным анодом:
(+)A : Fe0 − 2e = Fe2+
(−)K : 2H2O + 2e = H2 − +2OH − (см. выше)
Вторичный процесс: Fe2+ + 2OH − = Fe(OH)2 ↓ .
б) В растворе электролита нет условий для образования осадка с катионами металла анода; тогда эти катионы остаются в растворе и принимают участие в проводимости второго рода, как составная часть внутренней цепи. Например, электролиз раствора CuSO4 с медным анодом:
(+)A: Cu0 − 2e = Cu2+
(−)K : Cu2+ + 2e = Cu0
(т.е. металл переносится с анода на катод до полного растворения анода). Такой вид электролиза широко используется в технике.
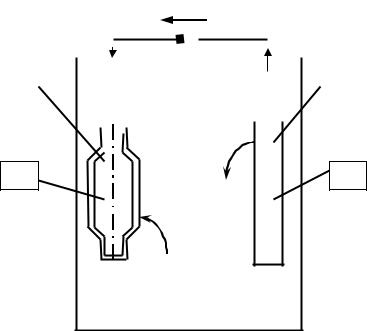
Применение электролиза с растворимым анодом.
1. Гальваностегия (покрытие одного металла другим).
Например, для покрытия стальной детали никелем в качестве анода используют брусок чистого Ni, а в качестве катода – покрываемую деталь, которую предварительно очищают (удаляют оксиды, обезжиривают, промывают и т.д.).
Электроды погружают в раствор хлорида никеля NiCl2 и подключают к полюсам источника постоянного тока (см. рис. 9.3):
(+)Анодный процесс: Ni0 − 2e = Ni2+
(–)Катодный процесс: Ni2+ + 2e = Ni0
Аналогичным образом осуществляют цинкование, меднение, хромирование и др.
Толщина покрытий в зависимости от их назначения может составлять от 1 до 100 мкм.
Например, медь, полученная и очищенная металлургическим способом, содержит в своём составе примеси (цинк, серебро и др.), которые ухудшают её электротехнические свойства и которые можно отделить от основного вещества только электрохимическим путём. Этим способом удаётся получить медь с содержанием основного ве-
щества 99,999%.
166
|
ē |
|
|
|
− |
|
+ |
e |
|||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
ē |
||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K( - ) |
|
|
|
|
|
|
|
|
|
|
( + ) A |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe |
Ni |
Ni 2+
Ni 2+
NiCl 2 → Ni 2 + + 2Cl −
Рис. 9.3. Схема гальваностегии
2. Рафинирование (очистка) металлов.
Брусок из черновой меди погружают в раствор CuCl2 и подключают к положительному полюсу источника постоянного тока
(+)Анод. В качестве (–) Катода используют тонкую пластинку (или фольгу) из чистой меди (см. рис. 9.4).
В процессе электролиза происходят следующие процессы:
С анода переходят в раствор сначала ионы цинка (Zn более активен), а затем – ионы меди:
(+)A : Zn0 − 2e = Zn2+ Cu0 − 2e = Cu2+
Примеси серебра при растворении бруска осыпаются на дно в виде осадка (анодный шлам), который затем удаляют.
На катоде в первую очередь восстанавливаются катионы Cu2+ , как ионы менее активного металла:
( - ) К: Cu2+ + 2e = Cu0
Катионы Zn2+ остаются в растворе (для их возможного последующего восстановления необходимо установить электрод из цинка и изменить параметры источника тока).
167

|
|
|
|
|
|
e |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К(–) |
ē |
|
|
– |
|
|
+ |
|
|
ē |
|||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
(+)А |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu |
|
|
|
|
|
|
|
Zn2+ |
|
||||||
|
|
|
|
|
|
|
|
||||||||
Cu+Zn+Ag...
Cu2+ 2+
CuCl2 → Cu2+ + 2Cl−
Рис.9.4. Схема процесса рафинирования.
3. Гальванопластика (получение точных копий).
Для получения тонкостенных изделий сложной формы ( например, сильфонов), которые любыми способами механической обработки изготовить невозможно, используют гальванопластику (рис. 9.5)
Для этого изготавливают форму из алюминия, на которую с помощью гальваностегии наносят слой меди нужной толщины (например, 100 мкм), после чего форму растворяют в соляной кислоте (HCl), с которой медь не реагирует.
δ=0,1 мм
Cu
Al
Рис. 9.5. Изготовление сильфона гальванопластикой.
168
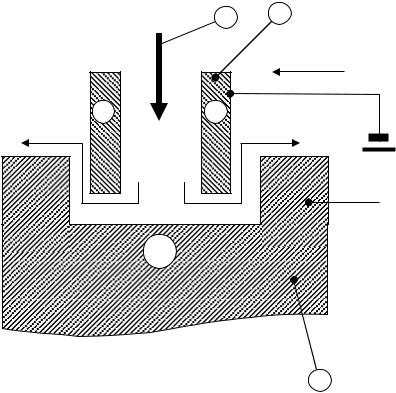
4. Электрохимическая обработка металлов (ЭХОМ):
− шлифовка и полировка; − обработка сверхтвёрдых металлов и сплавов;
− анодирование металлов (например, анодное оксидирование алюминия – покрытие поверхности алюминиевых деталей оксидом алюминия Al2O3).
1 2
е
– |
– |
_ |
+ 
 е
е
+
3
Рис. 9.6. Схема ЭХОМ: 1 – раствор электролита; 2 – катод (инструмент); 3 – анод (обрабатываемое изделие).
В настоящее время ЭХОМ используется для обработки лопаток турбин, штампов и пресс – форм, твёрдых и тугоплавких металлов и сплавов, получения и обработки отверстий различной формы (рис. 9.6), для фрезерования, точения и шлифования различных изделий, заточки инструмента и т.д.
9.4. Электролиз расплавов
Как известно, электрический ток является наиболее мощным окислителем и восстановителем. Такие активные металлы, как ще-
лочные, щелочноземельные, алюминий, не способные восстанавливаться из водных растворов их солей, могут быть восстановлены из расплавов своих соединений. На этом базируется пироэлектрометаллургический способ получения металлов.
169
Так, получение свободного фтора, окислить который химическим путём невозможно, основано на анодном окислении расплавов фторидов активных металлов.
Пример 1 .
Получение натрия и фтора электролизом расплава NaF:
|
t 0 |
|
|
Расплавление: NaF = Na+ + F − |
|||
Электролиз: |
(−)K : Na+ + e = Na0 |
|
|
(+)A : 2F − − 2e = F |
− |
||
|
|||
|
2 |
|
|
Пример 2.
Получение алюминия электролизом расплава оксида алюминия (глинозёма) Al2O3.
t0
Расплавление: 2Al2O3 = 4Al3+ + 6O2−
(−)K : 4Al3+ +12e = 4Al0
Электролиз: (+)A : 6O2− −12e = 3O2 −
(более подробно процесс получения алюминия будет рассматриваться ниже).
ГЛАВА 10. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА
В настоящее время в мире имеется более 10 млрд. индивидуальных химических источников тока. Их суммарная мощность, по некоторым оценкам, равна мощности всех электростанций. Ниже будут рассмотрены наиболее распространенные типы химических источников тока.
10.1. Гальванический элемент Лекланше
ЭДС любого работающего гальванического элемента с течением времени уменьшается из-за торможения анодного и катодного процессов:
-на аноде накапливаются ионы металла и его потенциал стано-
вится менее отрицательным;
-на катоде накапливаются электроны и его потенциал становит-
ся менее положительным.
Наибольшее значение имеет катодная (чаще всего водородная)
поляризация. Ее устраняют введением специальных веществ – деполяризаторов. В общем случае деполяризаторы – это вещества, принимающие электроны, т.е. окислители. Деполяризаторы часто ис-
170
