
Zakpita travma jivota
.pdfhepatoduodenale з її структурами. Якщо кровотеча зупинилася/то в портальних воротах відшукують a.hepatica propria і місце її біфуркації. По черзі перетискають a.hepatica sinistra et dextra, з'ясовуючи яка з них кровоточить і накладають лігатуру на пошкоджену, але дистальніше міхурової артерії, щоб запобігти некрозу жовчного міхура. І все ж таки перев'язка печінкової артерії допустима лише при надзвичайній необхідності, оскільки у 20-25% хворих ізза множинних сегментарних некрозів вона закінчується летально [А.С. Ермолов, М.М. Абакумов, 2000].
При пошкодженні позапечінковихсудинних структур накладають шви на v. cava inf.,v. porta, чи перев'язують a.hepatica propria [B.A. Рудаков и соавт.,
1998].
7. Рентгеноендоеаскулярна оклюзія. Для зупинки кровотечі із па-
ренхіматозних органів черевної порожнини, в першу чергу печінки, прогрес у інтервенційній рентгенорадіології та ендоваскулярній хірургії дав змогу застосовувати найбільш щадну, але ефективну методику - катетерну селективну чи суперселективну рентгенендоваскулярну оклюзію (емболізацію) артерій третього і четвертого порядку травмованого органа [Л.С. Зингерман и соавт., 1980; В.Г. Москвичев и соавт., 1988; Ю.В. Авдосьєв и соавт., 2003; Б.А. Сотниченко и соавт., 2003; S.K. D'Amours et al., 2001; A. Hagiwara et al., 2002; S. Kushimoto etal., 2003].
Рентгенендоваскулярна оклюзія - це досить швидкий і малотравматичний хоча і інвазивний метод самостійного гемостазу без хірургічного втручання. Це приклад, коли діагностична процедура трансформується в лікувальний метод. Емболізація показана при стабільній геодинаміці. У хворих з неконтрольованою кровотечею і тяжкому стані вона майже не застосовується [A. Hagiwara et al., 2002].
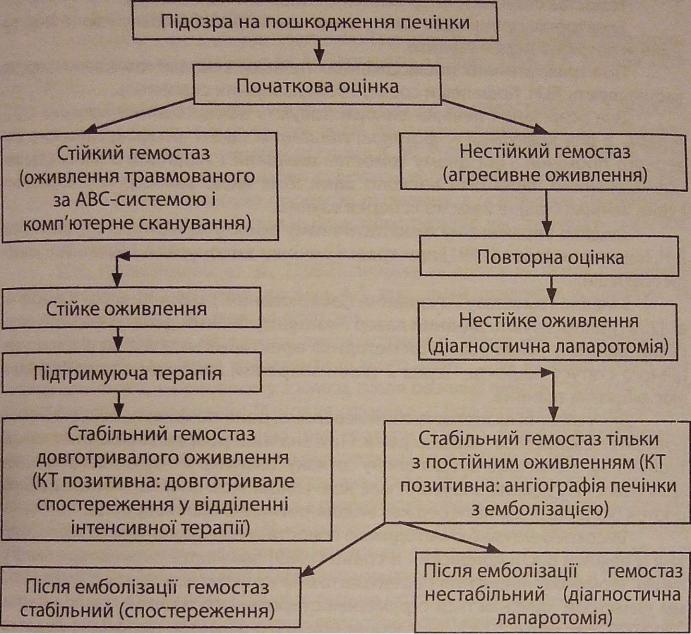
При массивному пошкодженні печінки [Г.Е. Белозеров и соавт., 1999; Н.Н. Stone et al., 1983; M.F. Rotondo et al., 1993; S. Kushimoto et al., 2003] доцільність тактики, яка базується на послідовних етапах: невідкладна (реанімаційна) лапаротомія з метою діагностики і зупинки кровотечі, тампонади; після стабілізації геодинаміки виконують ангіографію з емболізацією судин, що кровоточать; релапаротомія з метою контролю гемостазу і повної хірургічної корекції пошкоджень внутрішніх органів.
Якщо ж після ангіографії з емболізацією кровотеча продовжується, то необхідне оперативне втручання [H.L. Pachter et al., 1995]. Ангіографію з рентгенендоваскулярною оклюзією виконують і в другому варіанті, тобто відразу ж після операції, коли немає впевненості в ефективності тампонади рани печінки [І А Криворучко і соавт., 2004].
Методика рентгеноендоваскулярної емболізуючої оклюзії [В.В. Бойко и соавт., 2005]: а) проводять ангіографію (артеріогепатографію за Сельдінгером) і з'ясовують джерело кровотечі; б) вибирають емболізат в залежності від діаметра травмованої судини (артерія частки печінки чи сегмента); в) через катетер ендоваскулярно суперселективно в сегментарну артерію вводять дрібнодисперсні емболізуючі речовини із пенополіуретану (мікроемболи) або металеву (Пантурко) чи пластмасову (Кітнера) спіраль в артерію більшо-
221
го діаметра і блокують кровотік (дистально-паренхіматозна емболізація) [р Carrilloetai., 1999; J A Asensio et al., 2000]; в) внутрішньоартеріальна гемоаа тична терапія як самостійна чи як підготовка до операції (пітуїтрін, дИЦи нон, 5% розчин амінокапронової кислоти, 10% розчин хлористого кальцію). г)після емболізації із метою з'ясування її адекватності виконують контрольну ангіогепатографію. В.В. Бойко и соавт. [2005] зробили висновок, що рентгі нендоваскулярний катетериий гемостаз ефективний, менш травматичний метод хірургічного лікування при травмі печінки і дає можливість уникнути повторних лапаротомій з приводу рецидиву кровотечі. Такий спосіб гемостазу можливий, як вважають [D.L. Ciraulo et al., 1998], навіть при тяжкій (IV-VGT.) травмі печінки. Цими авторами розроблено алгоритм артеріальної емболізації печінки (рис. 23).
Оклюзія також незамінна для ліквідації посттравматичної гемобілії[А.Е. Борисов и соавт., 1998; В.Т. Зайцев и соавт., 1998; В.В. Бойко і співавт., 2001; 2005 Л.Ф. Никишин и соавт., 2001; М.Г. Урман, 2003].
Опубліковано [В.Т. Зайцев и соавт., 1998] унікальне спостереження травмованого (впав з мотоцикла), 17 років, якого оперовано (зашили рану печінки) за життєвими показаннями в ЦРЛ. З приводу жовчного перитоніту проведена релапаротомія, і ще одна в зв'язку з профузною шлунково-кишко- вою кровотечею, джерело якої і після гастротомії не було виявлено. Кровотеча повторювалася 8 разів. При ендоскопічному дослідженні в клініці спостерігалося витікання крові із фатерового сосочка. Ангіографією виявлено екстравазацію контрастної рідини в басейні лівої і правої печінкових артерій та аневризму 4,5x1 см. Діагностована гемобілія. Успішно проведена рентгеноендоваскулярна оклюзія власної печінкової артерії (3 спіралі Кітнера, 60 емболів 2x2x1 мм із пенополіуретану, 4 мл дицінону, 20 мл амінокапронової кислоти).
У потерпілих із відкритою чи тупою травмою живота, які у вкрай тяжкому стані, лапаротомія з метою зупинки кровотечі часто надто небезпечна. Альтернативним методом тимчасового гемостазу в таких ситуаціях можлива балонна оклюзія черевної аорти. Це технічно простий, але і більш ефективний спосіб. Дуже важливо, що його можуть виконувати не лише ангіорентгенологи (без рентгенологічного контролю), але і хірурги чи анестезіологи безпосередньо в відділенні інтенсивноїтерапіїта реанімації. Нажаль, оклюзія аорти може ускладнитися тяжким ішемічним ушкодженням внутрішніх органів і спинного мозку.
Методикам катетерного гемостазу, як уже давно з'ясовано ІШ Trojanowski et al., 1980], властиві не тільки переваги, але і недоліки, а саме:
а) методика селективної, а тим більше суперселективної, емболізації органа потребує часу, якого при кровотечі, що продовжується, завжди обмаль чи немає зовсім;
б) імовірні ішемічні розлади з небезпекою некрозу в органі, судини
якого емболізували; в) при балонній оклюзії аорти можуть виникнути пошкодження не лише віс-
церальних органів (черевної порожнини і заочеревинного простору), але і
222
спинного мозку;
Рис. 23. Алгоритм селективної артеріальної емболізацїїпри пошкод-
женні печінки (D.L. Ciraulo et al., 1998)
г) можливе продовження чи рецидив кровотечі із-за наявності коллатералей;
д) можливий викид емболу або його фрагментів із емболізованої артеріїз ризиком емболічних ускладнень;
е) інколи виникає спазм артерій; є) можливі алергічні реакції.
Пошук оптимальної діагностично-лікувальної тактики травмованим, У яких термінальний стан, кровотеча в порожнини, геморагічний шок, продовжується. Така екстремальна патологія вимагає перегляду традиційної концепції надання допомоги в першу „золоту годин/'на іншу доктрину - допомога в„золоті хвилини"[Н.К. Голобородько и соавт., 2003].
223
II. Фізичні методи гемостазу.
Гемостаз базується на дії високих і низьких температур. Електрокоагуляція дає змогу зупинити паренхіматозну кровотечу су
дини ж потрібно перев'язувати. ^ При травматичних пошкодженнях печінки з метою гемостазу широко
застосовують [В.Н. Кошелев и соавт.,-1985] лазерний скальпель.
Для розрізання печінки використовують зфокусований промінь лазера, а для коагуляції - фотокоагуляційний ефект розфокусованого лазерного проміння. При цьому гемостаз швидкий і надійний з мінімальним пошкодженням паренхіми навколо рани. Але якщо діаметр пошкоджених судин печінки більше 2 мм, то їх перев'язують.
Завдяки вираженому гемостатичному ефекту лазерного опромінення В.Н. Кошелев и соавт. [1991] при травмі печінки виконували резекційні методи операцій.
З метою гемостазу і з'єднання („зварювання") рани печінки Y.Wadiaet al. [2001] застосовують діодний лазер і концентрований денатурований людський альбумін. Важливо, що ця методика ефективна незалежно від коагуляційного статусу пацієнта. Через 2 тижні зварений альбумін поступово замінює фіброзна тканина.
Для успішної лазеркоагуляції невеликої рани печінки необхідне її знекровлення компресією навколо рани. При значних розривах використовують турнікет на печінково-дуоденальну зв'язку (маневр Pringle). Важливо, що крім гемостазу велике значення має коагуляція жовчних капілярів і дрібних проток (холестаз), що попереджає виділення жовчі після операції.
Високоефективною методикою гемостазу при паренхіматозній кровотечі із печінки В.А. Вишневский и соавт. [1989] вважають пневмотермокоагуляцію.Термокоагуляція при паренхіматозній кровотечі, а також із судин до-2 мм діаметром здійснюється струменем стерильного повітря температурою 200-500°С протягом 10-15 сек. Судини більшого діаметра н е о б х і д н о додатково перев'язувати.
При застосуванні плазмового скальпеля на поверхню рани діє потік високотемпературного (біля 900°С) газу, що у фізиці називають плазмою. Йонізований газ (плазма) утворюється, коли найбільш доступний інертним газ (аргон, гелій) пропускають через електричний заряд між двома електродами. Такий скальпель "розрізає" на глибину до 1 см, при цьому кровотеча зменшується у 6-7 разів. Розроблені нові апарати для плазмової хірургії, зокрема, хірургічний комплекс "Плазмомед" (на Південному машинобудівному заводі, м. Дніпропетровськ), за своїми можливостями наближуються до'Чд6" ального"скальпеля [Ю.А. Фурманов и соавт., 2003].
Позитивні якості плазмового скальпеля: повний гемостаз (у печінці виникає коагуляція судин діаметром до 2,5 мм), холестаз, аеростаз (коагуляція бронхів діаметром до 4мм), бактерицидність, абластика, значне скорочення терміну втручання, зниження числа ускладнень. Недоліки - пошкодження тканини глибиною до 1,5 мм в режимі коагуляції і до 0,7-0,9 мм при розрізан-
224
ні-
Як доведено в експерименті [Ю.А. Фурманов и соавт., 2003] розрив паренхіми заживає сполучною тканиною, яка проростає термічний струп і на 21-30 добу формується рубець.
Серед фізичних методів коагулююча дія найбільш властива плазмовим потокам і гранатовим лазерам [НА Ефименко и соавт., 1998; К.К. Козлов и соавт., 2003].
Ультразвуковий хірургічний аспіратор діє не гемостатично, а як дісектор - руйнує і зразу ж відсмоктує лише паренхіму печінки, не пошкоджуючи навіть дрібні судини і жовчні протоки [C.W. Putnam, 1983]. Оскільки легко верифікуються у товщі паренхіми судинно-секреторні елементи, то методика дає змогу більш безпечно провести економну, в основному сегментарну, резекцію. Аспіратор з успіхом використовується під час "резекцій-обробок" при травмах печінки.
D.N. Papachristou et al., [1982] печінку розділяють також струменем фізіологічного розчину під тиском 4-5 атм, який розмиває паренхіму, не пошкоджуючи судини і жовчні протоки.
При операціях на печінці використовують також метод кріорезекції і кріодеструкції на основі кріоагента рідкого азоту. Для зупинки паренхіматозної кровотечі, в основному з кукси, після резекції використовують інколи кріохірургічне обладнання "Кріоелектроніка-2" (кріоаплікатор прикладають до рани, яка замерзає під дією температури -190°С). Але після відтаювання часто паренхіматозна кровотеча відновлюється, а із судин 1 мм і більше виникає профузна кровотеча. Тому методика кріодеструкції тепер застосовується лише для деструкції пухлин. Для кріорезекції печінки у 1983р. розроблений [Б.И. Альперович, 1985; 2003] кріоскальпель, але він був малоефективним. Потім сконструйовані кріоультразву-ковий скальпель і кріовіброскальпель забезпечували повний гемостаз при паренхіматозній кровотечі, а також із судин до 1,5 мм діаметром. Більші ж судини потрібно перев'язувати.
Така методика кріорезекції потребує додаткового накладання по лінії резекції блоковидних швів, що полегшує операцію; знижує крововтрату за рахунок паренхіматозного гемостазу; полегшує візуалізацію судинно-труб- частих структур по лінії резекції [Б.И. Альперович и соавт., 1985; 2003].
Для дисекції тканин, у тому числі і паренхіматозних органів, зокрема печінки, роблять спроби [А.С. Юшкин и соавт., 2003] використовувати радіоніж. Але на лінії дисекції добитися надійного гемостазу ще не вдається, а тому для зупинки кровотечі застосовують інші фізичні методи (плазмовий потік), чи перев'язують судини.
Новим перспективним методом інтраопераційного гемостазу при операціях на печінці В.Д. Федоров и соавт. [2004] вважають використання апарату радіочастотної аблації. Але все ж таки перед резекцією сегмента чи частки органа необхідно виділити і перев'язати їх судинно-секреторні елементи.
Фізичні методи гемостазу із-за незабезпеченості апаратурою застосовуються дуже рідко, в основному лише в окремих столичних клініках. Нажал ь, більшість хірургів у наших умовах навіть не бачили вуглекислотний чи
225
гранатовий лазер, ультразвуковий скальпель "Факел-Г (плазменні поток
аргоновий коагулятор та ін.
III. Хімічні методи гемостазу
Це допоміжні засоби зупинки паренхіматозної кровотечі. Серед них найбільш розповсюджені ціанокрилатні клеї. Основною умовою їх місцевої дії - суха поверхня, а оскільки рана печінки кровоточить, то плівка із клею відривається і гемостаз не наступає. Застосовувалася також методика вве- дення медичного клею ін'єктором для створення гемостатичного інфільтра. ту. Оскільки клей токсичний, викликає специфічне запалення і формується
глибокий рубець, то ця методика не застосовується.
Друга група хімічних речовин (феракрил) теж малоефективна.
У 1976 р. запропоновано рідину капрофер ( аміфер). Ним змочують серветку, яку притискують до рани на 10-30 сек. Завдяки такій аплікації прискорюються коагулюючі і адгезивні властивості, настає хімічна коагуляція білків плазми крові, миттєво утворюється тромботична плівка і коагуляційний згусток, який надійно фіксується на поверхні рани. Проведені експериментальні морфологічні і клінічні дослідження [А.С. Девятов и соавт., 1993; 1994] як надійності гемостазу, так і заживления ран печінки. Після евтаназії тварин вивчалася надійність гемостазу методом гідропреси - у судини досліджуваного органу (печінка, селезінка, нирка) під тиском 250 мм рт.ст. вводили фізіологічний розчин. Через годину після застосування капроферу гер-
метизм рани зберігався у 93,5% тварин. У клінічних умовах після гемостазу
(судини 1-2 мм діаметром прошивають кетгутом) у рану вводять капрофер, її краї зближують, притискуючи 10-30 сек, і вони склеюються без утворення порожнини. Дослідження динаміки заживления ран печінки при застосуванні з метою гемостазу капроферу показали, що згусток проростає сполучною тканиною і вже на 8 добу утворюється ніжний рубець. Швидкій епітелізації рани сприяють біологічні особливості препарату (протинабрякова, протизапальна і антимікробна дія). Не менш важливо і те, що він не токсичний.
IV. Біологічні методи гемостазу
1.Тампонада рани сальником (оментогепатопексія). Це найбільш по-
ширений біологічний метод гемостазу. Його в хірургічну практику впровадив ще в 1899р. Н.Н. Болярський, який використовував ізольований сальник (цит. за Г.Ф. Ніколаевим, 1955). За рахунок тромбокінази, яка виділяється із нього, гемостаз при паренхіматозній кровотечі наступає швидко. Оскільки клапоть сальника, як правило, некротизується і виникає нагноєння, то від такої методики відмовились. Тепер використовують лише неізольований сальник, тобто на судинній ніжці. Експериментальними дослідженнями [C.B. Лохвицкий и соавт., 1998] доведено, що, по-перше, навіть при значній кровотечі аплікацією сальника досягають гемостазу; по-друге, при оментогепатопексії вже на 3-4 добу вростають капіляри.
У значний розрив печінки кладуть сальник на ніжці як тампон і окремими швами фіксують навколо рани [R.L. Reed, 1994]. Щоб кров і жовч не зби-
226
ралися в глибокій рані печінки, в неї крім сальника вводять ще і дренажну трубку [М.Г. Шевчук и соавт., 1988]. Отже, тампонада рани печінки великим неізольованим сальником - це "аутогенний тампон, тобто комбінація механічного і біологічного методів.
2. Тампонада матеріалами, що саморозсмоктуються. Викорис-
товують тампони із особливих сортів целюлози; гемостатичну марлю та вату, які через 10 днів розсмоктуються; сухий тромбін; гемостатичну губку із плазми крові (діє і механічно, закриваючи просвіт судини, і як біологічний агент, оскільки містить тромбін і тромбопластин, які прискорюють тромбоутворен-
ня). З .Комбіноване застосування біологічних засобів. Використовують
одночасно сальник і гемостатичну губку. Для більш надійної адгезії ми додавали ще й антибіотик у сухому вигляді. Для цього після висушування на поверхню рани швидко висипають порошок ампіциліну 1,0-2,0 г (окрім антибактеріальної дії підвищується клейкість у рані), потім кладуть губку, зверху якої розрив тампонують неізольованим сальником. Поверх нього серветками притискають рану на 7-10 хвилин. Якщо кровотечі немає або майже зупинилася, серветки видаляють, а сальник окремими швами фіксують навколо травмованої ділянки.
Л.фібриновий клей. Це біологічна речовина. Він готується ex tempore із компонентів (фібриноген, тромбін, хлористий кальцій, XIII фактор згортання крові). Клей наносять на поверхню рани або вводять шприцом у паренхіму органа. За декілька хвилин внаслідок полімеризації утворюється фібрин. Основна перевага цього клею в тому, що він ефективний і при порушенні згортання крові.
Т.В. Хоробрих и соавт. [2005] фібриновий клей використовують при поверхневих тріщинах і розривах паренхіми, в першу чергу труднодоступної задньодіафрагмальної поверхні печінки. Але при кровотечі із судин діаметром більше 2 мм, великому розходжені країв рани, їх зшивають з фіксацією великого сальника. Це дало можливість не порушувати цілість реберної дуги, не проводити гепатопексію чи тампонаду рани печінки. У групі потерпілих з вкрай тяжким станом і нестабільною гемодинамікою автори з успіхом використовували фібриновий клей при лапароскопічній методиці гемостазу. Дослідженнями доведено, що фібриновий адгезив є безпосереднім пластичним матеріалом, стимулятором регенерації і імунобіологічним регулятором репаративних процесів. Автори показали, що фібриновий клейовий гемостаз в ізольованому вигляді ефективний у 52% пацієнтів.
Цю біологічну речовину застосовують у вигляді висококонцентрованого розчину фібриногену, який отримують методом кріопреципітації (концентрація фібриногену 60 г/л), препарату тромбіну і хлористого кальцію.
5.ТахоКомб. При операціях на паренхіматозних органах абсолютно незамінним, тому що найбільш ефективним, в останні роки вважають [ Н.А. Ефименко и соавт., 1998; А.А. Гринберг и соавт., 1998; В.А. Горский, 2001; А.Н. Смирнов и соавт., 2002; К.М. Курбонов и соавт., 2007] біополімер ТахоКомб (фірма "Нікомед" Австрія). Це абсорбуючий гемостатичний засіб для місцево-
227
го застосування у вйґляді колагенової пластини розміром 9,5x4,5x0,5 см к 3,0x2,5x0,5 cm (герметично запакована в подвійну оболонку, завдяки ш гемостатичні властивості зберігаються до 3 років). Вона покрита з однсг боку компонентами фібринового клею, до складу якого входять висококо^ центрований фібриноген, тромбін та апротинін. Роббча поверхня просочу на рибофлавіном; При контакті з кровоточивою поверхнею вказані фактори згортання активуються, звільнюються і тромбін перетворює фібриногену фібрин, наступає фаза згортання'крові і утворюється фібриновий згусток. Гемостатичний ефект посилюється ще і тому, що колаген стимулює агрегацію тромбоцитів. Апротинін перешкоджає передчасному фібринолізу плазміном. Пластину «Тахокомбу» без попереднього змочуваня кладуть робочою поверхнею до рани так, щоб и Краї були на 1,5-2 см на непошкодженій частині органа. Якщо поверхня рани велика, пластини кладуть у вигляді черепиці.
Пластину тампоном притискують 3-4 хв., при значній кровотечі - 5-7 хв і вона завдяки полімеризації і надзвичайній адгезії приклеюється. Тампон видаляють повільно, обережно, щоб з тампоном не відірвалася і пластина, яка до нього часто приклеюється. Коли пластину випадково відривають, то вертати її на місце недоцільно, оскіл ьки вона вже втрачає свої властивості. Компоненти пластини ферментативно розщеплюються, вона поступово розсмоктується. Доведено [В.А. Горский и соавт., 2006], що біополімер Тахокомб стимулює фібропластичну реакцію і ангіогенез. В термін від 30 до 60 днів настає повна регенерація пошкодженої тканини.
При порівнянні гемостатичних властивостей колагенової губки, «Таботампу», «Геласпону», «Тахокомбу» в експерименті і клінічних умовах для гемостазу із печінки беззаперечно показана ефективність лише «Тахокомба» [В.А. Горский и соавт., 2006]. Отже, це ефективний, досить перспективний, але поки що дорогий засіб.
6. Резекція печінки. До біологічного методу зупинки кровотечі відносять і резекцію печінки. Біологічному методу, без сумніву, властиві елементи і механічного гемостазу.
Неможливо не погодитися із пропозицією [B.C. Шапкин и соавт., 1977], що при пошкодженнях печінки її резекція обов'язково повинна бути включена в обсяг втручань/інакше деякі хворі не отримають повноцінного лікування.
Це одна із необхідних всього арсеналу операцій при пошкодженні печінки. Але такі втручання, особливо великі і гранично великі резекції, в тому числі гемігепатектомії, допустимі і можливі лише у спеціалізованих лікувальних закладах, де є досвід планових резекцій печінки при новоутвореннях, оскільки при травмі втручання виконуються в значно складніших умовах [В.Н. Климов и соавт., 1983]. Ми повністю розділяємо ці точки зору.
"Проблема резекції печінки - це в основному проблема зупинки кровотечі" [Н.И. Ищенко, 1966] (с.360). Дане положення владно буде звучати, напевно, завжди, незважаючи на впровадження у гепатологічну хірургію новітніх методів фізичного гемостазу. Тому, перш ніж розпочати мобілізацію печінки/для попередження профузної кровотечі із нижньої порожнистої вени
228
навколо неї нижче і вище печінки багато авторів [Г.И. Веронський, 1970; 1983 та ін.] пропонують підводити турнікети.
Слід відмітити, що до сих пір існує деяка розбіжність у назві оперативних втручань на печінці. А, насправді, термінологію операцій на цьому органі, виходячи із сегментарної будови за портальною системою, запропонували Патель та Куіно ще у 1955р. на XVI Міжнародному конгресі хірургів у Копенгагені.
1.Правобічна і лівобічна гемігепатектомії (Рис.24,25).
2.Зонектомії: а) видалення лівої латеральної зони, тобто класичної лі- вої частки печінки (тепер ця операція називається лівобічна кавальна лобектомія) (Рис. 26); б) видалення лівої парамедіанної зони; в) видалення правої парамедіанноїзони; г) видалення правої латеральної зони.
3.Сегментектомії (I, III, VI сегментів).
4.Інтермедіарна операція - видалення одним блоком правої і лівої парамедіанної зони.
5.Розширена гемігепатектомія - видалення правої або лівої половини печінки і парамедіанноїзони протилежної половини органа.
6.Розширена зонектомія - наприклад, видалення лівої парамедіанної зони з IIГ сегментом.
Розрізняють види резекції печінки: а) анатомічні або типові; б) атипові (економні). Методики цих втручань детально описані лише при плановій хірурги [В.В. Виноградов, 1962; И.Н. Ищенко., 1966; B.C. ІІІапкин, 1967; Ю.М. Дедерер и соавт., 1975; В.Г. Акопян, 1982; Г.И. Веронский, 1983; Э.И. Гальперин и соавт., 1987; В.А. Журавлев, 1986].
Виділяють 3 способи резекцій печінки: 1) з попередньою перев'язкою судинно-секреторних елементів часток чи сегментів органа; 2) з поступовою транспаренхімальною перев'язкою цих елементів; 3) з накладанням гемостатичних швів [Э.И. Гальперин, 1980]. Але завжди необхідно притримуватися основного правила - всі типові і атипові операції повинні виконуватися з урахуванням внутрішньоорганної архітектоніки судин та жовчних проток [В.В. Виноградов, 1962; B.C. Шапкин, 1967; Г.И. Веронский, 1983].
229
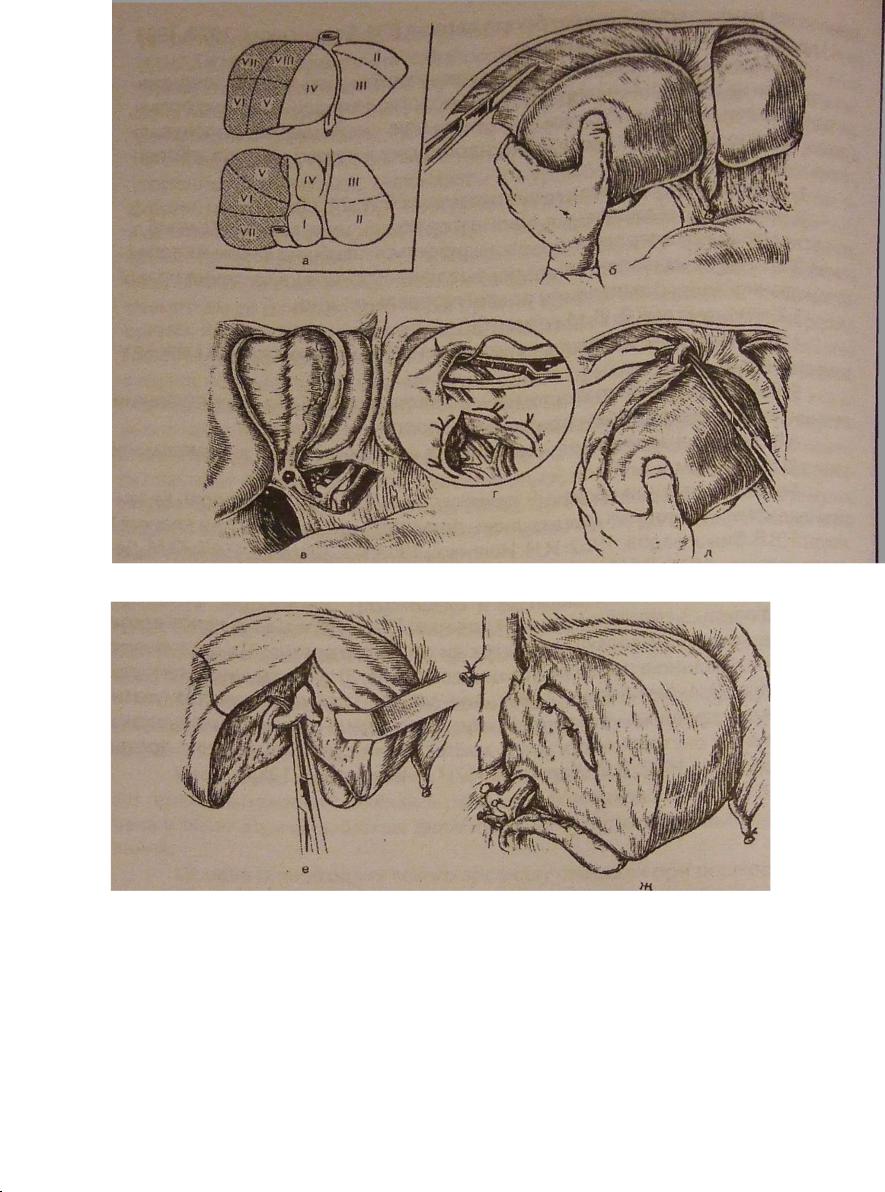
Рис. 24Правобічна гемігепатектомія |
(В.Г.Акопян, 1982) |
а - заштриховані V-VIII сегменти, що |
п о в и н н і б у т и видалені; б - мо- |
білізація правої частки п е ч і н к и ( р о з р і з а ю т ь |
lig. triangulare et lig. coronarium |
dextrae); в - м о б і л і з о в а н о ж о в ч н и й міхур; в п о р т а л ь н и х в о р о т а х перев'язані і перерізані судини правої частки печінки; г - методика в и д і л е н н я судин при закритому типі воріт печінки; д - в и д і л е н н я і п е р е в ' я з к а п р а в о ї печінково
вени; е - тканина печінки розрізана |
в з д о в ж с е р е д и н н о ї щілини; перев'язка |
правої гілки сагітальної вени; ж - вид |
р а н и п е ч і н к и після в и д а л е н н я право |
п о л о в и н и органа. |
|
230 |
|
j
