
- •Химия учебное пособие
- •Оглавление
- •Введение
- •Тема 1. Систематика химических законов.
- •1.1 Основные стехиометрические законы и расчеты по уравнениям реакций Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •112 Г железа выделяет 67,2 л водорода 5,6 .103 г железа выделяет vх л водорода
- •Задачи для самостоятельного решения
- •1.2 Основные классы неорганических соединений
- •Основные теоретические положения
- •Характер взаимодействия и генетическая связь между основными классами неорганических соединений представлены на рисунке.
- •Решение типовых задач
- •Тема 2. Строение вещества
- •2.1. Строение атома. Периодическая система элементов д.И.Менделеева Содержание материала для самостоятельного изучения
- •Литература: [1 – гл.1, §§ 1.1…1.4]; [2 – гл.1, §§ 1.1….1.4]; [3 – гл.Іі, §§ 17…19; гл.III, §§ 25…34]. Решение типовых задач
- •Задачи для самостоятельного решения
- •2.2. Химическая связь и строение простых молекул
- •Основные теоретические положения
- •Решение типовых задач
- •2.3. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •Тема 3. Общие закономерности химических процессов
- •3.1 Энергетика химических процессов. Химическое сродство
- •Литература: [1 – гл.5, §§ 5.1…5.4]; [2 – гл.І,іі §§ 1.1…1.4, 2.1…2.3]; [3 – гл.Vі, §§ 55,56,66…68].
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие
- •Литература: [1 – гл.V, §§ 5.5, 7.1-7.3]; [2 – гл.VI, §§ 6.1-6.6];
- •Основные теоретические положения
- •Решение типовых задач
- •Согласно уравнению Вант–Гоффа:
- •Задачи для самостоятельного решения
- •Тема 4. Растворы
- •4.1. Способы выражения концентрации растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл.4, § 4.1]; [2 – гл.7, §§7.1, 7.2]; [3 – гл.VII§§ 73…77]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •Константы диссоциации некоторых слабых электролитов при 25оС
- •Задачи для самостоятельного решения
- •4.3 Водородный показатель рН.
- •Отсюда находим водородный показатель раствора сн3соон:
- •Решение. Соль nh4no3 образована слабым основанием nh4oh и сильной кислотой hno3. При растворении она диссоциирует на ионы:
- •Задачи для самостоятельного решения
- •4.4 Жесткость воды и методы ее устранения Содержание материала для самостоятельного изучения
- •Литература: [1 - гл.12, § 12.3]; [2 - гл.VIII, § 8.6]; [3 - гл.VII, § 69; гл. XIX, §§ 211,212]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Стандартные электродные потенциалы в водных растворах
- •Задачи для самостоятельного решения
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Задачи для самостоятельного решения
- •Коррозия и защита металлических конструкций Содержание материала для самостоятельного изучения
- •Тема 6. Специальные разделы химии
- •6.1. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Литература: [1 - гл.8, 15, §§ 8.7; 15.3]; [2 – гл.7, § 7.8]; [3-гл.Х, §§ 105…109; 112…114]. Основные теоретические положения
- •Молекулы пав обозначены общепринятым символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •6.2. Основы химии неорганических вяжущих веществ Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Задачи для самостоятельного решения
- •6.3. Органические соединения. Полимеры
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Библиографический список
- •Заключение
- •Варианты контрольных заданий
2.2. Химическая связь и строение простых молекул
Содержание материала для самостоятельного изучения
Химическая связь и валентность элементов. Основные типы химической связи: ковалентная (полярная, неполярная), ионная, металлическая. s- и p-связь. Характеристики связи: энергия, длина, направленность, насыщенность, полярность, поляризуемость.
Литература: [1 – гл.2, §§ 2.1…2.5]; [2 – гл.2, §§ 2.1…2.3]; [3 – гл.IV, §§ 38…42].
Основные теоретические положения
Молекула – это устойчивое скопление атомов. Силы, удерживающие атомы в молекуле, принято характеризовать понятием химическая связь.
Химическая связь образуется за счет валентных электронов, но осуществляется по разному.
Различают три основных типа химической связи: ковалентную, ионную и металлическую.
Ковалентная связь, согласно электронным представлениям, возникает за счет образования общей электронной пары, или , с ковалентных представлений, перекрывания электронных облаков, принадлежащих разным атомам.
В образовании связи участвуют только одинарные (неспаренные) электроны по одному от каждого атома, имеющие противоположные значения спинового квантового числа.
Если электронное облако, образованное общей электронной парой, распределено (расположено) симметрично относительно ядер атомов и принадлежит им в равной степени, то такая связь называется ковалентной неполярной. Этот вид связи наблюдается, обычно, в молекулах, образованных атомами с одинаковой электроотрицательностью. Например, Н2, Сl2, F2, N2, О2 и т.д.
В молекулах, атомы которых различаются по своим свойствам, электронное облако смещено с атому с большей электроотрицательностью. Такая ковалентная связь называется полярной.
Рассмотренный вид ковалентной связи имеет обменный механизм. Возможно возникновение ковалентной связи по донорно-ак-епторцному механизму между атомами элементами, один из которых имеет в возбужденном состоянии неподеленную электронную пару (донор), а другой – свободную орбиталь (акцептор). Этот вид связи образуется только в возбужденном состоянии, когда использованы все связи по обменному механизму.
Ионная связь – результат электростатического взаимодействия противоположно заряженных ионов. Ионная связь является предельным случаем ковалентной полярной связи.
Ионная связь возникает за счет перехода валентного электрона с атомной орбитали типичного металла на атомную орбиталь типичного неметалла. При этом атом типичного металла превращается в положительно заряженный ион, а атом неметалла приобретает отрицательный заряд. Между противоположно заряженными ионами возникает сила электростатического притяжения (ионная связь).
Решение типовых задач
Задача 1.Укажите тип химической связи в молекулах F2, НF,КF.
Решение. В молекуле F2 связь ковалентная неполярная. Валентные электроны в атомах расположены на последнем уровне 2s22р5 следующим образом:
|
|
|
|
2s рz ру рх
|
|
|
|
Каждый атом фтора имеет три неподеленные электронные пары и один неспаренный электрон. Неспаренные электроны фтора связываются в общую электронную пару. Между атомами фтора возникает одна ковалентная связь:
.. .. .. ..
: F . + . F : : F ( : ) F:
.. .. .. ..
В образовании связи принимают участие электроны атомных орбиталей (А.О.) типа рх:


рх рх
Происходит перекрывание электронных облаков и образуется облако связи или молекулярная орбиталь (М.О.) типа . Электронная пара или молекулярная орбиталь (облако связи) расположено симметрично, то есть на одинаковом расстоянии от ядер атомов фтора. Электроны, участвующие в образовании связи антипараллельны. -связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов. Связь в молекуле F2 –одинарная.
В молекуле НF электронное облако смещено к атому с большей электроотрицательностью – фтору. Связь – ковалентная полярная.
.. ..
Н∙ + ∙ F: Н ( : ) F:
∙∙ ∙∙
|
1s - валентный электрон водорода
2s рz ру рх - валентные электроны фтора
|
|
|
|


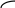
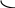
s pх
Задача 2. Определите валентность и степень окисления хлора в молекулах Cl2 , НСl, НОСl.
Решение. Валентность определяется числом химических связей, которыми атом одного элемента удерживает атомы других элементов в соединении.
Под степенью окисления понимается заряд иона элемента в соединении, вычисленный из предположения, что молекула состоит только из ионов.
В молекуле Cl2 имеется одна связь, следовательно, хлор одно-валентен.
.. .. .. ..
:Сl . + .Cl: :Cl ( : ) Cl: или
. . . . . . . .
3s рz ру рх - валентные электроны одного атома хлора
|
|
|
|
3s рz ру рх - валентные электроны другого атома хлора
|
|
|
↓ |
Поскольку молекула состоит из одинаковых атомов и электронное облако, образованное, общей электронной парой не смещается ни к одному из атомов, то степень окисления хлора равна нулю.
В молекуле НСl валентность хлора равна одному, так как в этом соединении имеется одна связь:
Н. + . Сl : Н ( : ) Сl : или
∙ ∙ ∙ ∙
1s - валентный электрон атома водорода
-
3s рz ру рх
|
|
|
|
Степень окисления хлора равна (-1), так как электронная пара смещена от водорода к хлору, электроотрицательность которого выше.
В молекуле НОСl между атомами кислорода и хлора возникает одна связь, поэтому хлор одновалентен.
.. .. .. ..
Н . + . О . + . Сl : Н ( : ) О (: ) Сl : . . . . . . . .
1s
|
2s 2р
|
|
|
|
3s 3р
|
|
|
|
Водород (как правило) и щелочные металлы в соединениях имеют степень окисления +1, кислород, как правило, минус 2.
Соединение НОСl электронейтрально, поэтому степень окисления хлора равна +1.
Задача 3. Определите для атомов фтора и брома валентность в нормальном и в возбужденном состояниях. Объясните, почему атом фтора, находящийся в одной группе с бромом не может проявить валентность, равную номеру группы?
Решение. Электронные формулы атомов фтора и брома:
9F 1s22s22p5 ; 35 Br 1s22s22p63s23p64s23d104p5.
Валентность в нормальном и в возбужденном состояниях определяется количеством неспаренных электронов, то есть количеством одинарных связей по обменному механизму. При возбуждении атома возможно распаривание электронов, но только в пределах одного энергетического уровня.
Валентные электроны брома - 4s24p 5.
Изобразим распределение валентных электронов по квантовым ячейкам в атомах фтора и брома и определим их валентность в нормальном и возбужденном состояниях
Для атома фтора:
|
|
|
|
2s 2р
Валентность в нормальном состоянии – В0F = 1(один одинарный валентный электрон).
Валентность в возбужденном состоянии - ВF =1(электронам некуда распариваться, нет свободных ячеек на последнем уровне).
Для атома брома имеем следующее распределение валентных электронов в нормальном состоянии:
-
¯
¯
¯
4s 4p 4d
Валентность брома в нормальном состоянии – В0 = 1, так как имеется один неспаренный электрон на р-орбитали (одна ковалентная связь).
При возбуждении атома происходит распаривание электронов, то есть переход электронов с 4s и 4р орбиталей на 4d. Получается 3,5,7 неспаренных электронов соответственно:
Возбужденное состояние атома:
-
4s 4p 4d
Валентность в возбужденном состоянии - В* = 3, 5, 7.
Таким образом, у атома фтора на втором уровне, где находятся валентные электроны, нет свободных орбиталей, поэтому и нет возможности к распариванию электронов и увеличению ковалентных возможностей. Поэтому фтор не может проявить валентность, равную номеру группы, а бром может, так как на четвертом уровне существует d-орбиталь и она свободна.
Задачи для самостоятельного решения
61. Определите валентность и степень окисления углерода в соединениях СН4, СО2, СО.
62. Определите валентность и степень окисления элементов в молекулах Na2SiO3, CaSO4, MgCO3.
63. Укажите тип химической связи в молекулах NaCl, N2, Cl2, H2S. Ответ мотивируйте.
64. Охарактеризуйте свойства ковалентной связи: насыщаемость, длину; полярность, поляризуемость.
65. Какая химическая связь называется ковалентной? Какие типы ковалентной связи вы знаете? Как будет изменяться характер химической связи в ряду:
NaCl MgCl2 AlCl3 SiCl4PCl5SCl2Cl2 ?
66. Какая связь называется ионной? Каковы ее особенности по сравнению с ковалентной? При взаимодействии атомов каких элементов может образоваться ионное соединение? Как будет изменяться характер химической связи в ряду: КСl СаСl2 FeСl2GeCl4 Cl2 ?
67. Укажите, в какой молекуле – НСl, НВr, НJ - связь более полярная (дипольные моменты соответственно равны: 1,06; 0,79; 0,42 Д). Ответ мотивируйте.
68. Что является количественной мерой полярности ковалентной связи? Какая из молекул – Н2О, Н2S, Н2Se - более полярна и почему?
69. Какую валентность, обусловленную неспаренными электронами, может проявить сера в нормальном и в возбужденном состояниях? Ответ мотивируйте распределением валентных электронов атома серы по квантовым ячейкам. Почему атом кислорода, стоящий в одной группе с серой, не может проявить валентность, равную номеру группы?
70. Какую валентность, обусловленную неспаренными элек-тронами, может проявить хлор в нормальном и в возбужденном со-стояниях? Ответ мотивируйте распределением валентных электронов атома хлора по квантовым ячейкам. Почему атом фтора, стоящий в одной группе с хлором, не может проявить валентность, равную номеру группы?
71. Как изменится полярность связи Н - Э в ряду : Н2ОН2SН2Se Н2Те?
72. Какую ковалентную связь называют -связью и какую - -связью? Укажите, сколько и каких связей осуществляется в молекуле азота. Как можно объяснить ее высокую устойчивость?
73. Какая связь называется металлической, в каких случаях она возникает? Чем отличается структура кристаллов натрия от структуры кристаллов хлорида натрия? Какой вид связи осуществляется в этих кристаллах?
74. Какая химическая связь называется водородной? Каковы особенности соединений с водородной связью? Почему Н2О и НF, имея меньшую молярную массу, плавятся и кипят при более высокой температуре, чем их аналоги Н2S и НСl?
75. Какую валентность, обусловленную неспаренными элек-тронами, может проявить йод в нормальном и в возбужденном со-стояниях? Ответ мотивируйте распределением валентных электронов атома йода по квантовым ячейкам. Почему атом фтора, стоящий в одной группе с йодом, не может проявить валентность, равную номеру группы?
76. В чем состоит донорно-акцепторный механизм образования ковалентной связи? Разберите на примере образования молекулы NH4Cl.
77. Как с помощью величины электроотрицательности объяснить последовательность в изменении дипольного момента в соединениях: Н2О, Н2S, Н2Se?
78. Что называется дипольным моментом молекулы? Как с помощью величины электроотрицательности объяснить последовательность в изменении дипольного момента в соединениях: Н2, НСl, НВr, НJ?
79. Пользуясь значениями относительных электроотрица-тельностей атомов К(0,91); Са(1,04); Аl(1,6); Сl(3,0), вычислите их разность для связей К – Сl, Са - Сl, Аl – Cl. Какая из связей характеризуется наибольшей степенью ионности?
80. Зная, что молекула Н2О полярная, а СО2 неполярная, укажите угловое или линейное строение имеют эти молекулы. Какая из связей характеризуется наибольшей степенью ионности?
