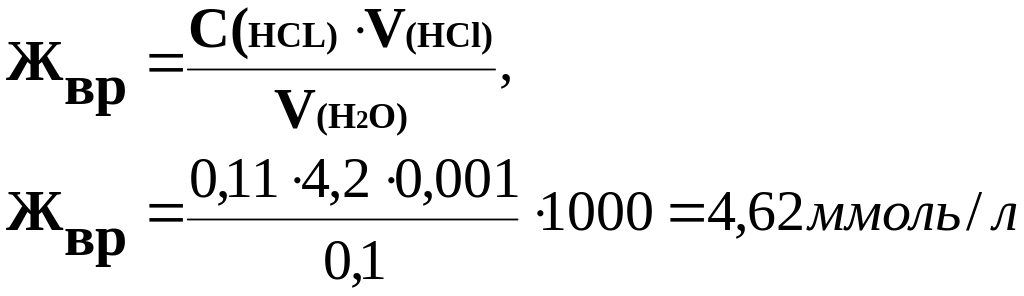- •Химия учебное пособие
- •Оглавление
- •Введение
- •Тема 1. Систематика химических законов.
- •1.1 Основные стехиометрические законы и расчеты по уравнениям реакций Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •112 Г железа выделяет 67,2 л водорода 5,6 .103 г железа выделяет vх л водорода
- •Задачи для самостоятельного решения
- •1.2 Основные классы неорганических соединений
- •Основные теоретические положения
- •Характер взаимодействия и генетическая связь между основными классами неорганических соединений представлены на рисунке.
- •Решение типовых задач
- •Тема 2. Строение вещества
- •2.1. Строение атома. Периодическая система элементов д.И.Менделеева Содержание материала для самостоятельного изучения
- •Литература: [1 – гл.1, §§ 1.1…1.4]; [2 – гл.1, §§ 1.1….1.4]; [3 – гл.Іі, §§ 17…19; гл.III, §§ 25…34]. Решение типовых задач
- •Задачи для самостоятельного решения
- •2.2. Химическая связь и строение простых молекул
- •Основные теоретические положения
- •Решение типовых задач
- •2.3. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •Тема 3. Общие закономерности химических процессов
- •3.1 Энергетика химических процессов. Химическое сродство
- •Литература: [1 – гл.5, §§ 5.1…5.4]; [2 – гл.І,іі §§ 1.1…1.4, 2.1…2.3]; [3 – гл.Vі, §§ 55,56,66…68].
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие
- •Литература: [1 – гл.V, §§ 5.5, 7.1-7.3]; [2 – гл.VI, §§ 6.1-6.6];
- •Основные теоретические положения
- •Решение типовых задач
- •Согласно уравнению Вант–Гоффа:
- •Задачи для самостоятельного решения
- •Тема 4. Растворы
- •4.1. Способы выражения концентрации растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл.4, § 4.1]; [2 – гл.7, §§7.1, 7.2]; [3 – гл.VII§§ 73…77]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •Константы диссоциации некоторых слабых электролитов при 25оС
- •Задачи для самостоятельного решения
- •4.3 Водородный показатель рН.
- •Отсюда находим водородный показатель раствора сн3соон:
- •Решение. Соль nh4no3 образована слабым основанием nh4oh и сильной кислотой hno3. При растворении она диссоциирует на ионы:
- •Задачи для самостоятельного решения
- •4.4 Жесткость воды и методы ее устранения Содержание материала для самостоятельного изучения
- •Литература: [1 - гл.12, § 12.3]; [2 - гл.VIII, § 8.6]; [3 - гл.VII, § 69; гл. XIX, §§ 211,212]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Стандартные электродные потенциалы в водных растворах
- •Задачи для самостоятельного решения
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Задачи для самостоятельного решения
- •Коррозия и защита металлических конструкций Содержание материала для самостоятельного изучения
- •Тема 6. Специальные разделы химии
- •6.1. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Литература: [1 - гл.8, 15, §§ 8.7; 15.3]; [2 – гл.7, § 7.8]; [3-гл.Х, §§ 105…109; 112…114]. Основные теоретические положения
- •Молекулы пав обозначены общепринятым символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •6.2. Основы химии неорганических вяжущих веществ Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Задачи для самостоятельного решения
- •6.3. Органические соединения. Полимеры
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Библиографический список
- •Заключение
- •Варианты контрольных заданий
4.4 Жесткость воды и методы ее устранения Содержание материала для самостоятельного изучения
Природные соединения кальция. Известняки, мергели, природный сульфат кальция. Оксид и гидроксид кальция, получение, свойства и применение. Карбонат и гидрокарбонат кальция и их взаимопревращения.
Жесткость воды, ее происхождение и единицы измерения. Временная и постоянная жесткость. Методы умягчения воды: термический, реагентный, ионного обмена.
Литература: [1 - гл.12, § 12.3]; [2 - гл.VIII, § 8.6]; [3 - гл.VII, § 69; гл. XIX, §§ 211,212]. Основные теоретические положения
Жесткость воды обусловлена присутствием в ней солей кальция и магния. Суммарное содержание этих солей определяет общую жесткость воды. Общая жесткость складывается из временной жесткости и постоянной.
Жесткость воды, обусловленная наличием в воде гидрокарбонатов кальция и магния, называется временной, так как ее можно установить кипячением. При этом гидрокарбонаты разлагаются с образованием углекислоты и выпадающих в осадок карбонатов и гидроксидов:
Ca(HCO3)2↔CaCO3↓+H2O+CO2↑
Mg(HCO3)2↔Mg(OH)2↓+2CO2↑
Все соли, оставшиеся в воде после кипячения (хлориды, сульфаты, нитраты), обусловливают постоянную (некарбонатную) жесткость.
Жесткость (Ж) воды выражают числом миллимоль (ммоль) эквивалентов ионов кальция и магния, содержащихся в 1л воды. Масса ммоль эквивалентов Са2+ и Мg2+ равна соответственно: Ммэ(Са2+) = 20мг/ммоль, Ммэ(Mg2+)=12 мг/ммоль
Жобщ=m (Ca2+)/Ммэ (Са2+)+m (Mg2+)/Ммэ (Mg2+) (4.4.1)
В зависимости от содержания солей жесткости все воды делятся на мягкие (до3,0 ммоль/л), средней жесткости (3,0-6,5 ммоль/л), жесткие (6,5-11,0 ммоль/л), очень жесткие (более 11,0 ммоль/л).
В зависимости от требований к качеству умягченной воды жесткость можно снизить разными методами: термическим, реагентным, ионного обмена.
Реагентный метод заключается в связывании ионов Са2+ и Mg2+ химическими веществами в трудно растворимые соединения – карбонат кальция, гидроксид магния, фосфаты кальция и магния.
Метод ионного обмена основан на обмене ионов ионита (катиона и аниона) на ионы, содержащиеся в воде и обусловливающие жесткость.
Решение типовых задач
Задача 1. Рассчитайте временную, постоянную и общую жесткость воды (ммоль/л), если в 0,25л воды содержится 16,1 мг гидрокарбоната кальция, 2,92г гидрокарбоната магния, 11,1мг хлорида кальция и 9,5 мг хлорида магния
Решение. Жесткость воды выражается числом ммоль эквивалентов солей кальция и магния, содержащихся в 1л воды
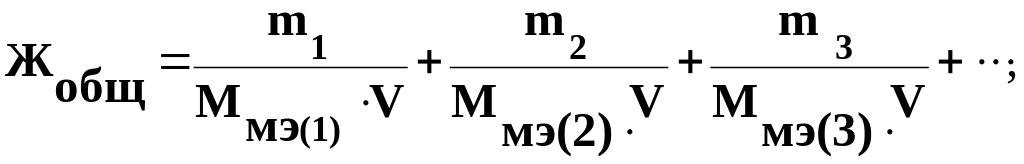
где m1, m2, m3 – масса солей в воде, мг; Ммэ(1), Ммэ(2), Ммэ(3) – масса ммоль эквивалентов солей, мг/ммоль; V – объем воды, л.
Масса моль эквивалента солей численно равна молярной массе ее эквивалента, но выражена в мг/ммоль и для Са(НСО3)2, Mg(HCO3)2, CaCL2, MgCL2 соответственно равна, мг/ммоль: 81, 73, 55,5 и 47,5
Временная жесткость (Жвр) равна:
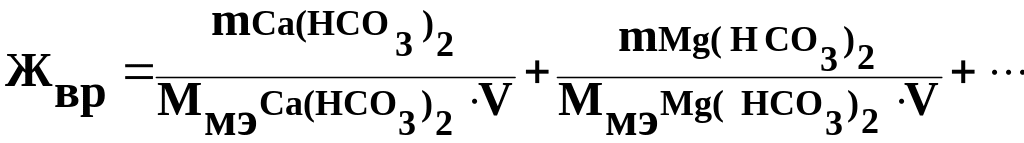
Жвр =.1/81·0.25 + 2.92/73·0.25 = 0.96 ммоль/л.
Постоянная жесткость (Жп) равна:
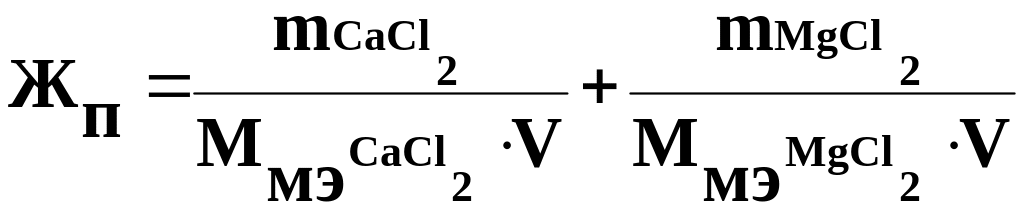 Ж
п
= 11.1/55.5·0,25
+ 9,5/47,5·0,25=1,6 ммоль/л.
Ж
п
= 11.1/55.5·0,25
+ 9,5/47,5·0,25=1,6 ммоль/л.
Общая жесткость воды равна сумме временной и постоянной жесткости:
Жобщ = Жвр + Жп = 0,96+1,6=2,56 ммоль/л.
Задача 2. Для устранения общей жесткости по известково-содовому методу к 100л воды добавлено 14,8г Са(ОН)2 и 10,6г Na2CO3. Рассчитайте временную, постоянную и общую жесткость воды.
Решение. Известь, добавленная в воду, устраняет временную жесткость, а сода – постоянную. При этом протекают следующие реакции:
Ca(HCO3)2 + Ca(OH)2=2CaCO3↓+2H2O
Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3+2H2O
Ca(NO3)2+Mg(NO3)2+2Na2CO3→CaCO3↓+MgCO3↓+4NaNO3
В соответствии с законом эквивалентов, добавленные в воду известь и сода провзаимодействуют с эквивалентным количеством соответствующих солей, поэтому жесткость воды можно выразить следующими соотношениями:
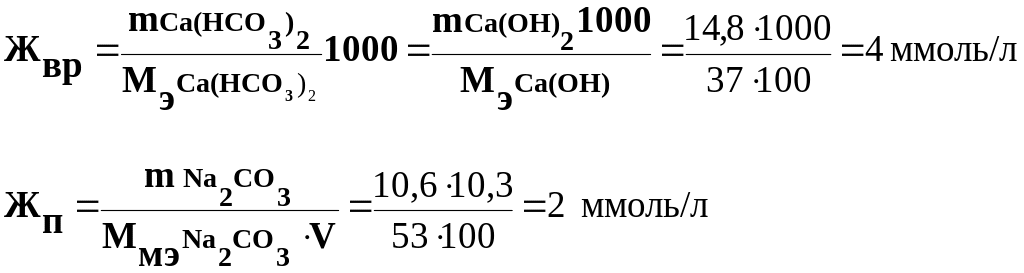
Жобщ = Жвр+ Жп = 6 ммоль/л, что отвечает средней жесткости воды.
Задача 3. При определении временной жесткости на титрование 0,1 л воды израсходовано 4,2∙10-3л раствора соляной кислоты, молярная концентрация эквивалента которой равна 0,11 моль/л . Рассчитайте временную жесткость воды.
Решение. В основе определения временной жесткости лежит реакция
Са(НСО3)2 + НСl → СаСl2 + Н2О +СО2
В основе вычисления жесткости воды лежит закон эквивалентов - количество эквивалентов НСl равно количеству эквивалентов гидрокарбонатов Са и Мg, вступивших в реакцию с кислотой. Расчет проводится по формуле: