
- •Химия учебное пособие
- •Оглавление
- •Введение
- •Тема 1. Систематика химических законов.
- •1.1 Основные стехиометрические законы и расчеты по уравнениям реакций Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •112 Г железа выделяет 67,2 л водорода 5,6 .103 г железа выделяет vх л водорода
- •Задачи для самостоятельного решения
- •1.2 Основные классы неорганических соединений
- •Основные теоретические положения
- •Характер взаимодействия и генетическая связь между основными классами неорганических соединений представлены на рисунке.
- •Решение типовых задач
- •Тема 2. Строение вещества
- •2.1. Строение атома. Периодическая система элементов д.И.Менделеева Содержание материала для самостоятельного изучения
- •Литература: [1 – гл.1, §§ 1.1…1.4]; [2 – гл.1, §§ 1.1….1.4]; [3 – гл.Іі, §§ 17…19; гл.III, §§ 25…34]. Решение типовых задач
- •Задачи для самостоятельного решения
- •2.2. Химическая связь и строение простых молекул
- •Основные теоретические положения
- •Решение типовых задач
- •2.3. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •Тема 3. Общие закономерности химических процессов
- •3.1 Энергетика химических процессов. Химическое сродство
- •Литература: [1 – гл.5, §§ 5.1…5.4]; [2 – гл.І,іі §§ 1.1…1.4, 2.1…2.3]; [3 – гл.Vі, §§ 55,56,66…68].
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие
- •Литература: [1 – гл.V, §§ 5.5, 7.1-7.3]; [2 – гл.VI, §§ 6.1-6.6];
- •Основные теоретические положения
- •Решение типовых задач
- •Согласно уравнению Вант–Гоффа:
- •Задачи для самостоятельного решения
- •Тема 4. Растворы
- •4.1. Способы выражения концентрации растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл.4, § 4.1]; [2 – гл.7, §§7.1, 7.2]; [3 – гл.VII§§ 73…77]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •Константы диссоциации некоторых слабых электролитов при 25оС
- •Задачи для самостоятельного решения
- •4.3 Водородный показатель рН.
- •Отсюда находим водородный показатель раствора сн3соон:
- •Решение. Соль nh4no3 образована слабым основанием nh4oh и сильной кислотой hno3. При растворении она диссоциирует на ионы:
- •Задачи для самостоятельного решения
- •4.4 Жесткость воды и методы ее устранения Содержание материала для самостоятельного изучения
- •Литература: [1 - гл.12, § 12.3]; [2 - гл.VIII, § 8.6]; [3 - гл.VII, § 69; гл. XIX, §§ 211,212]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Стандартные электродные потенциалы в водных растворах
- •Задачи для самостоятельного решения
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Задачи для самостоятельного решения
- •Коррозия и защита металлических конструкций Содержание материала для самостоятельного изучения
- •Тема 6. Специальные разделы химии
- •6.1. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Литература: [1 - гл.8, 15, §§ 8.7; 15.3]; [2 – гл.7, § 7.8]; [3-гл.Х, §§ 105…109; 112…114]. Основные теоретические положения
- •Молекулы пав обозначены общепринятым символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •6.2. Основы химии неорганических вяжущих веществ Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Задачи для самостоятельного решения
- •6.3. Органические соединения. Полимеры
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Библиографический список
- •Заключение
- •Варианты контрольных заданий
4.3 Водородный показатель рН.
ГИДРОЛИЗ СОЛЕЙ
Содержание материала для самостоятельного изучения
Электролитическая диссоциация воды. Ионное произведение во- ды. Водородный показатель и шкала рН. Понятие об индикаторах. Гидролиз солей по катиону, аниону, по катиону и аниону. Условия смещение равновесия реакции гидролиза.
Литература: [1 – гл.8, §§ 8.5, 8.6]; [2 - гл.VII, §§ 44, 46];
[3 – гл.VII, §§ 90, 92].
Основные теоретические положения
Вода является слабым электролитом, молекулы воды в незначительной степени диссоциируют на ионы: H2O ↔ H+ + OH-
Ионное произведение воды KH2O = [H+] · [OH-] = 10-14. Эта величина является постоянной для данной температуры (295 K0) и увеличивается с ростом температуры.
Концентрация ионов водорода и гидроксид-ионов в воде одинаковая: [H+] = [OH-] = 10-7 – среда нейтральная.
Избыток ионов Н+ в растворе обусловливает кислую реакцию раствора, а избыток ионов ОН- - щелочную.
Водородный показатель рН характеризует среду водного раствора (нейтральная, кислая, щелочная).
Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода:
рН = - lg [H+] и [H+] = 10-pH
В нейтральной среде: [H+] = [OH-] = 10-7 и рН = 7
В кислой среде: [H+] > [OH-], т.е. [H+] > 10-7 и рН < 7
В щелочной среде: [H+] < [OH-], т.е. [H+] < 10-7 и рН > 7
При растворении в воде солей, как правило, происходит изменение рН, если соль подвергается гидролизу. Гидролиз соли – это процесс взаимодействие ионов соли с ионами воды, в результате которого происходит связывание ионов воды (Н+ и ОН-) в малодиссоциирующие соединения. Гидролиз – процесс обратимый.
Гидролизу подвергаются соли, образованные слабым основанием и сильной кислотой (NH4Cl; CuSO4; Fe(NO3)2 и др.), сильным основанием и слабой кислотой (Na2CO3; K2S; Ca(NO2)2 и др.), слабым основанием и слабой кислотой ((NH4)2CO3; (CH3COO)2Cu и др.) т.е. те, которые при взаимодействии с водой образуют слабый электролит или ионы плохо диссоциирующие в дальнейшем.
Соли образованные сильным основанием и сильной кислотой гидролизу не подвергаются (KCl; Ca(NO3)2; Na2SO4).
Решение типовых задач
Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(ОН)2 полной.
Решение. рН = - lg [H+]. Гидроксид кальция при диссоциации образует ионы кальция и гидроксид-ионы. Концентрация ионов ОН- связана с концентрацией ионов Н+ ионным произведением воды:
[H+] · [OH-] = 10-14. Отсюда [H+] = 10-14 / [OH-]
Из уравнения диссоциации Ca(OH)2 ↔ Ca2+ + 2 OH- следует, что [OH-] = 2 [Ca(OH)2] = 2 · 0,005 = 0,01 моль/л.
[H+] = 10-14/0,01 = 10-12 моль/л; рН = - lg 10-12 = 12.
Задача 2. Водородный показатель раствора азотистой кислоты рН=3, степень диссоциации α = 0,01. Вычислите молярность (См) кислоты.
Решение. Так как водородный показатель рН = - lg [H+], то [H+] = 10- pH = 10- 3 моль/л. Из уравнения диссоциации азотистой кислоты HNO2 ↔ H+ + NO2-, следует, что [H+] = [HNO2]дисс. Из выражения α = [HNO2]дисс. / [HNO2]общ. следует, что
![]()
![]()
Задача 3. Вычислите рН раствора уксусной кислоты с молярной концентрацией 0,17 моль/л. Константа диссоциации СН3СООН равна 1,75 · 10-5.
Решение. Уксусная кислота – слабый электролит. Константа диссоциации Кд слабого электролита и степень диссоциации α связаны между собой соотношением ______________
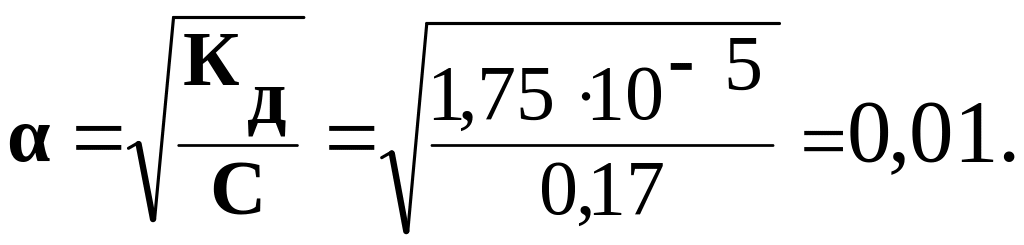
Из
уравнения диссоциации уксусной кислоты
СН3СООН
↔ СН3СОО-
+ Н+
следует, что концентрация ионов Н+
(СН+)
равна
концентрации молекул кислоты, распавшихся
на ионы:
СН+=ССН3СООН,дисс.
Концентрация
ионов водорода вычисляется
из выражении
для степени диссоциации:
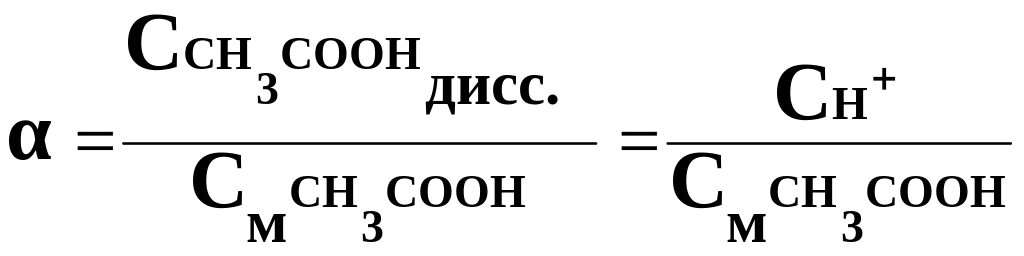 ;
;
СН+ = α · СМ = 0,01 · 0,17 = 1,7 10-3 моль/л
