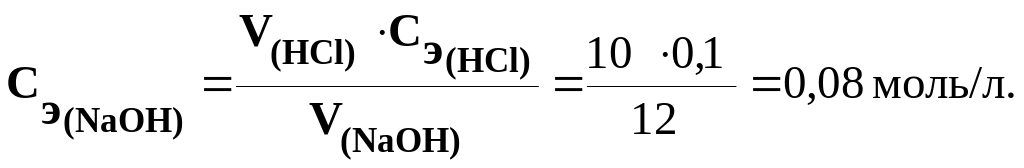- •Химия учебное пособие
- •Оглавление
- •Введение
- •Тема 1. Систематика химических законов.
- •1.1 Основные стехиометрические законы и расчеты по уравнениям реакций Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •112 Г железа выделяет 67,2 л водорода 5,6 .103 г железа выделяет vх л водорода
- •Задачи для самостоятельного решения
- •1.2 Основные классы неорганических соединений
- •Основные теоретические положения
- •Характер взаимодействия и генетическая связь между основными классами неорганических соединений представлены на рисунке.
- •Решение типовых задач
- •Тема 2. Строение вещества
- •2.1. Строение атома. Периодическая система элементов д.И.Менделеева Содержание материала для самостоятельного изучения
- •Литература: [1 – гл.1, §§ 1.1…1.4]; [2 – гл.1, §§ 1.1….1.4]; [3 – гл.Іі, §§ 17…19; гл.III, §§ 25…34]. Решение типовых задач
- •Задачи для самостоятельного решения
- •2.2. Химическая связь и строение простых молекул
- •Основные теоретические положения
- •Решение типовых задач
- •2.3. Окислительно-восстановительные реакции
- •Задачи для самостоятельного решения
- •Тема 3. Общие закономерности химических процессов
- •3.1 Энергетика химических процессов. Химическое сродство
- •Литература: [1 – гл.5, §§ 5.1…5.4]; [2 – гл.І,іі §§ 1.1…1.4, 2.1…2.3]; [3 – гл.Vі, §§ 55,56,66…68].
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие
- •Литература: [1 – гл.V, §§ 5.5, 7.1-7.3]; [2 – гл.VI, §§ 6.1-6.6];
- •Основные теоретические положения
- •Решение типовых задач
- •Согласно уравнению Вант–Гоффа:
- •Задачи для самостоятельного решения
- •Тема 4. Растворы
- •4.1. Способы выражения концентрации растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл.4, § 4.1]; [2 – гл.7, §§7.1, 7.2]; [3 – гл.VII§§ 73…77]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •Константы диссоциации некоторых слабых электролитов при 25оС
- •Задачи для самостоятельного решения
- •4.3 Водородный показатель рН.
- •Отсюда находим водородный показатель раствора сн3соон:
- •Решение. Соль nh4no3 образована слабым основанием nh4oh и сильной кислотой hno3. При растворении она диссоциирует на ионы:
- •Задачи для самостоятельного решения
- •4.4 Жесткость воды и методы ее устранения Содержание материала для самостоятельного изучения
- •Литература: [1 - гл.12, § 12.3]; [2 - гл.VIII, § 8.6]; [3 - гл.VII, § 69; гл. XIX, §§ 211,212]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Стандартные электродные потенциалы в водных растворах
- •Задачи для самостоятельного решения
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Задачи для самостоятельного решения
- •Коррозия и защита металлических конструкций Содержание материала для самостоятельного изучения
- •Тема 6. Специальные разделы химии
- •6.1. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Литература: [1 - гл.8, 15, §§ 8.7; 15.3]; [2 – гл.7, § 7.8]; [3-гл.Х, §§ 105…109; 112…114]. Основные теоретические положения
- •Молекулы пав обозначены общепринятым символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •6.2. Основы химии неорганических вяжущих веществ Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Задачи для самостоятельного решения
- •6.3. Органические соединения. Полимеры
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Библиографический список
- •Заключение
- •Варианты контрольных заданий
Тема 4. Растворы
4.1. Способы выражения концентрации растворов Содержание материала для самостоятельного изучения
Общая характеристика растворов. Растворимость. Способы выражения концентрации растворов: массовая доля (процентная концентрация по массе), молярная концентрация (молярность), молярная концентрация эквивалента (нормальность).
Литература: [1 – гл.4, § 4.1]; [2 – гл.7, §§7.1, 7.2]; [3 – гл.VII§§ 73…77]. Основные теоретические положения
Истинные растворы – это гомогенные термодинамически устойчивые системы. Растворы состоят из растворителя и растворенного вещества.
Под растворимостью вещества понимают концентрацию вещества в насыщенном растворе при данных температуре и давлении.
Растворение является сложным физико-химическим процессом, включающим несколько стадий. Разрушение химических и межмолекулярных связей требует затраты энергии и протекает с увеличением энтропии (ΔН1> 0). Гидратация растворенного вещества протекает с выделением тепла (ΔН2 <0). Распределение гидратов в растворе и перемешивание раствора в результате диффузии происходит с поглощением энергии ( ΔН3>0). Суммарный тепловой эффект ( ΔН = ΔН1 + ΔН2 +ΔН3 ) может быть как положительным (эндотермический процесс, ΔН>0), так и отрицательным (экзотермическое растворение, (ΔН<0).
Растворение – это самопроизвольно протекающий процесс (Δ G<0, ΔG = ΔH - T∙ΔS). Изменение энтропии (ΔS), как и тепловой эффект (ΔH), может быть положительным (ΔS > 0) и отрицательным (ΔS < 0).
Растворение кристаллических тел чаще процесс эндотермический, сопровождается увеличением энтропии, поэтому растворимость большинства твердых веществ увеличивается с ростом температуры.
Растворение газов в воде происходит с уменьшением энтальпии и убылью энтропии, в результате чего растворению газов в воде способствуют низкие температуры.
Решение типовых задач
Задача 1. Массовая доля растворенного вещества.
Определите массовую долю (%) соляной кислоты в растворе, содержащем 27,2 г HCl в 0,250 л раствора ( = 1050 г/л)
Решение. Массовая доля () показывает, сколько единиц массы (г, кг) растворенного вещества содержится в 100 единицах массы (г, кг) раствора. Массовая доля - безразмерная величина, ее выражают в долях единицы или процентах:
ω = (m1 / m)·100, ( 4.1)
где - массовая доля (%) растворенного вещества; m1 - масса растворенного вещества, г; m - масса раствора, г.
Масса раствора (m) равна произведению объема раствора (V) на его плотность ()
M = ρ·V и ω = [m1 / (ρ·V)]·100%
Массовая доля соляной кислоты в растворе равна:
ω = [27,2 /(1050·0,250)]·100 = 10,34 %
Задача 2. Молярная концентрация раствора.
Вычислите массу сульфата калия, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,73 моль/л.
Решение. Молярная концентрация (молярность) раствора показывает количество растворенного вещества (моль) содержащегося в 1 л раствора.
Молярную концентрацию (СМ) выражают в моль/л
Cм=m1/(M·V) ( 4.2 )
где m1 - масса растворенного вещества, г; М - молярная масса растворенного вещества, г/моль; m1/М - количество растворенного вещества, моль; V - объем раствора, л.
Масса K2SO4, содержащегося в растворе, равна (m1)
m1 = CM ∙ M ∙ V = 0,73 моль/л ∙ 174 г/моль ∙ 0,2 л = 25,4 г.
Задача 3. Молярная концентрация эквивалента.
Определите молярную концентрацию эквивалента сульфата железа (III), если в 0,2 л раствора содержится 6,67 г Fe2(SO4)3.
Решение. Молярная концентрация эквивалента (нормальность раствора) показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1 л раствора
CЭ=m1/(MЭ·V) ( 4.3 )
где m1 - масса растворенного вещества, г; Мэ - молярная масса эквивалента вещества, г/моль; m1/Mэ - число молярных масс эквивалента, моль; V - объем раствора, л.
Молярная масса эквивалента Fe2(SO4)3 равна
![]()
Молярная концентрация эквивалента раствора Fe2(SO4)3 равна
![]()
Задача 4. Вычисления, связанные с пересчетом концентраций растворов из одних единиц в другие.
Вычислите молярную концентрацию и молярную концентрацию эквивалента раствора, в котором массовая доля H2SO4 равна 15 %. Плотность раствора 1105 г/л.
Решение. Молярная масса и молярная масса эквивалента H2SO4 равны: M (H2SO4) = 98 г/моль; Мэ (H2SO4) = 98/2 = 49 г/моль.
Масса 1 л раствора: m = ρ · V = 1105 г/л · 1 л = 1107 г. В этой массе раствора содержится 15% H2SO4, т.е. 1105 · 0,15 = 165,75 г, что составляет: 165,75 г: 98 г/моль = 1,69 моль и 165,75 г: 49г/моль = 3,38 молярных масс эквивалента .
Молярная концентрация и молярная концентрация эквивалента соответственно равны 1,69 моль/л и 3,38 моль/л.
Задача 5. Расчеты, связанные с приготовлением разбавленных растворов из концентрированных.
Какой объем раствора азотной кислоты с массовой долей HNO3 30 % (ρ = 1180 г/л) требуется для приготовления 5 л азотной кислоты, молярность которой 0,5 моль/л.
Решение. Определим массу азотной кислоты (m1) в 5 л раствора, молярность которого 0,5 моль/л.
CM (HNO3) = m1/M·V и m1 = СМ·М·V
m1 = = 0,5 моль/л · 63 г/моль · 5 л = 157,5 г
Затем
определим, в каком объеме раствора HNO3
с ω = 30 % и ρ = 1180 г/л содержится 157,5 г
HNO3.
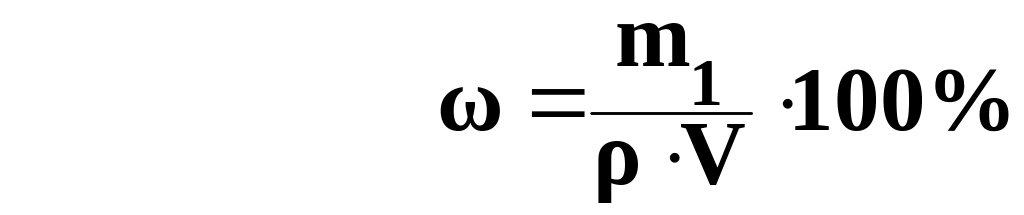 и V=(157,5·100)/(30·1180)=
0,44л
и V=(157,5·100)/(30·1180)=
0,44л
Для приготовления 5 л раствора азотной кислоты СМ (HNO3) = 0,5 моль/л, надо израсходовать 0,44 л раствора азотной кислоты с массовой долей HNO3 30 %.
Задача 6. Определить нормальность раствора NaOH, если на нейтрализацию 10 мл раствора соляной кислоты с молярной концентрацией эквивалента 0,1 моль/л израсходовано 12 мл раствора NaOH
Решение. Из закона эквивалентов следует, что количество вещества эквивалента щелочи равно количеству вещества эквивалента кислоты в реакции нейтрализации кислоты щелочью;
V(HCl) · Cэ (HCl) = VNaOH · Cэ(NaOH)
Отсюда