
- •Часть 1
- •О главление
- •Предисловие
- •После изучения дисциплины необходимо знать
- •После изучения дисциплины необходимо уметь
- •Содержание дисциплины
- •Самостоятельная работа студентов и контроль знаний студентов
- •После изучения главы необходимо знать
- •Простейшие интегралы
- •После изучения главы необходимо знать
- •2 Рис. 2.1 Рис. 2.1 .1. Кинематика материальной точки
- •Примеры решения задач
- •2.2. Кинематика абсолютно твердого тела
- •Примеры решения задач
- •2.3. Динамика материальной точки
- •Примеры решения задач
- •2.4. Законы сохранения
- •Примеры решения задач
- •2.5. Динамика абсолютно твердого тела
- •Примеры решения задач
- •2.6. Механика деформируемых тел
- •2.7. Механика жидкостей и газов
- •М етоды определения вязкости.
- •2.8. Неинерциальные системы отсчета
- •Пример решения задачи
- •2.9. Специальная теория относительности
- •Примеры решения задач
- •После изучения главы необходимо знать
- •3.1. Гармонические колебания
- •3.2. Свободные незатухающие механические колебания
- •С другой стороны, при малых углах
- •3.3. Затухающие механические колебания
- •3.4. Вынужденные механические колебания. Резонанс
- •3.5. Упругие волны
- •После изучения главы необходимо знать
- •4.1. Основные положения и определения
- •4.2. Уравнение состояния идеального газа
- •4.3. Внутренняя энергия и теплоемкость идеального газа
- •4.4. Кинетическая теория идеального газа
- •4.5. Реальные газы
- •Вопросы для самоконтроля к разделу 1: Элементы векторного анализа
- •К разделу 2: Физические основы механики
- •К разделу 3: Колебания и волны
- •К разделу 4: Молекулярная физика и термодинамика
- •Т олковый словарь
- •Инертность тел – свойство, присущее всем телам и заключающееся в том, что тела оказывают сопротивление изменению их скорости (как по модулю, так и по направлению).
- •Кинематика – раздел механики, изучающий движение тел без рассмотрения причин, которые это движение обуславливают.
- •З аключение
- •Б иблиографический список
- •Краткий курс физики
- •Часть 1
- •394026 Воронеж, Московский просп.,14
4.4. Кинетическая теория идеального газа
Основное
уравнение кинетической теории идеального
газа.
С точки зрения молекулярно-кинетической
теории, газ считается идеальным, если
можно пренебречь потенциальной энергией
взаимодействия его молекул (по сравнению
с кинетической энергией) и размерами
молекул (по сравнению со средним
расстоянием между ними). Давление газа
на стенку возникает в результате
многочисленных упругих соударений
молекул между собой и со стенками сосуда.
(Удар можно считать в среднем упругим,
так как газ находится со стенкой в
тепловом равновесии). Вследствие
беспорядочного движения молекул и
равновероятности всех направлений
можно считать, что
![]() всех молекул N
в объеме V
движется вдоль оси х,
–
вдоль оси у,
– вдоль оси z.
Основное
уравнение кинетической теории идеального
газа
выражает давление через средний квадрат
скорости молекул v2:
всех молекул N
в объеме V
движется вдоль оси х,
–
вдоль оси у,
– вдоль оси z.
Основное
уравнение кинетической теории идеального
газа
выражает давление через средний квадрат
скорости молекул v2:
р
=
![]() nv
=
nm0v2
=
nv
=
nm0v2
=
![]() nпост
=
n
nпост
=
n![]() ,
,
г
![]() – концентрация молекул, m0
– масса одной молекулы,
= m0v
–
ее импульс, v²
=
– концентрация молекул, m0
– масса одной молекулы,
= m0v
–
ее импульс, v²
=
![]() – квадрат средней квадратичной скорости
молекул, пост
=
- средняя кинетическая энергия
поступательного движения молекул. Если
связь энергии и импульса отличается от
классического, то равенство, например,
для газа фотонов, имеющих импульс
=
– квадрат средней квадратичной скорости
молекул, пост
=
- средняя кинетическая энергия
поступательного движения молекул. Если
связь энергии и импульса отличается от
классического, то равенство, например,
для газа фотонов, имеющих импульс
=
![]() ,
в результате приобретает вид р
=
n.
,
в результате приобретает вид р
=
n.
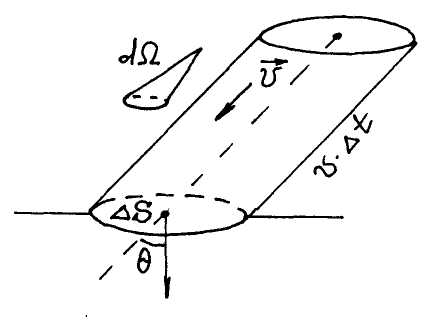
Число молекул ∆N, величину энергии ∆Е и т. д., которые переносятся через площадку ∆S за время ∆t, получают разбиением молекул на группы по скоростям в интервале значений от v до v + dv и по направлению в телесном угле dΩ (рис. 4.9).
П
Рис. 4.9
Рис. 4.9
dn(v,
v
+ dv,
dΩ)
= dn
(v,
v
+ dv)![]() .
.
Все молекулы в выделенном цилиндре попадут на площадку ∆S за время ∆t. Произведя последовательное интегрирование, можно получить соотношения для числа частиц и для величины энергии, которые переносятся через ∆S за время ∆t, соответственно:
![]() и
и
![]() .
.
В кинетической теории газов доказывается, что если две подсистемы могут обмениваться энергией, то в состоянии равновесия оказываются равными средние кинетические энергии поступательного движения их молекул. Исходя из этого, кинетическая теория газов определяет температуру как величину, пропорциональную средней кинетической энергии поступательного движения молекулы:
пост
=
![]() kT,
kT,
где k – постоянная Больцмана, которая выражается через универсальную газовую постоянную и число Авогадро. Коэффициент пропорциональности выбран так, чтобы уравнение состояния идеального газа
р = nkT = kT
совпадало с уравнением pV = RT.
Средняя квадратичная скорость поступательного движения молекул вычисляется по формулам:
vквадр
=
![]() ,
,
где = m0n – плотность газа.
Степени
свободы молекул.
Важной характеристикой идеального газа
является число
степеней свободы
его молекул i.
У одноатомной молекулы есть только три
степени свободы, соответствующие
поступательному движению: i
= i![]() = 3. У жесткой двухатомной молекулы, кроме
поступательных, есть еще две вращательные
степени свободы (полярные углы, задающие
ее направление в пространстве): i
= i
+ i
= 3. У жесткой двухатомной молекулы, кроме
поступательных, есть еще две вращательные
степени свободы (полярные углы, задающие
ее направление в пространстве): i
= i
+ i![]() = 3 + 2 = 5. У жесткой многоатомной (нелинейной)
молекулы – три вращательные степени
свободы, поэтому i
= 6. В классической статической физике
доказывается теорема о равнораспределении
энергии по степеням свободы: на любую
степень свободы, которой в выражении
для энергии молекулы соответствует
член х2
или
= 3 + 2 = 5. У жесткой многоатомной (нелинейной)
молекулы – три вращательные степени
свободы, поэтому i
= 6. В классической статической физике
доказывается теорема о равнораспределении
энергии по степеням свободы: на любую
степень свободы, которой в выражении
для энергии молекулы соответствует
член х2
или ![]() ,
приходится средняя энергия
,
приходится средняя энергия
![]() kT
в расчете на одну молекулу. Средняя
энергия одной молекулы и внутренняя
энергия всего газа принимают вид:
kT
в расчете на одну молекулу. Средняя
энергия одной молекулы и внутренняя
энергия всего газа принимают вид:
= iфkT, U = N = iфRT.
Физическое число степеней свободы iф в случае жестких молекул совпадает с математическим i. Однако, когда оказываются возбужденными колебательные степени свободы (при Т ~ 10³ К), то на каждую колебательную степень свободы будет приходиться (с учетом потенциальной энергии колебаний) средняя энергия kT. В результате получим
iф = iпост + iвращ + 2iкол,
где iкол обозначает математическое число колебательных степеней свободы. Для N – атомной молекулы iкол = 3N – ( iпост + iвращ ).
С учетом степеней свободы получим выражения для теплоемкостей идеального газа и его показателя адиабаты:
C
=
![]() ,
C
=
,
C
=
![]() ,
=
,
=
![]() .
.
Закон Дальтона гласит, что давление смеси (двух) идеальных газов равно сумме их парциальных давлений (давление, которое имел бы газ смеси, если бы он один занимал объем смеси):
р = р1 + р2 = (n1 + n2)kT = (1 + 2)RT.
Внутренняя энергия смеси равна сумме внутренних энергий:
U
=
![]()
RT
+
RT
+
![]()
RT.
RT.
Эта формула позволяет вывести следующие соотношения:
- эффективное число степеней свободы: i (1 + 2) = i11 + i22,
-
эффективные молярные теплоемкости:(1+
2)C
=
1C![]() +
2C
+
2C![]() ,
,
- эффективную молярную массу: (1 + 2) = 11 + 22.
Распределение Максвелла. Распределение молекул по скоростям описывается следующими функциями:
(v
)dv
=
![]() ,
(v)dv
=
,
(v)dv
=
![]() ,
,
(v)dv
dv![]() dv
dv![]() =
=
![]() .
.
Определение любой функции распределения основано на утверждении, что доля молекул, попадающих (в среднем) в очень маленький интервал данной переменной (скорости, проекции скорости, энергии), пропорциональна ширине этого интервала (dv обозначает физически, а не математически, бесконечно малый интервал – он должен содержать большое число молекул). Средняя доля молекул, обладающих некоторым признаком (например, попадающих в заданный интервал скоростей), можно трактовать как вероятность того, что произвольная молекула обладает признаком. Поэтому функцию распределения иногда называют плотностью вероятности.
Перечислим свойства функции распределения (на примере (v)):
Доля частиц (вероятность) в конечном интервале (v1, v2):
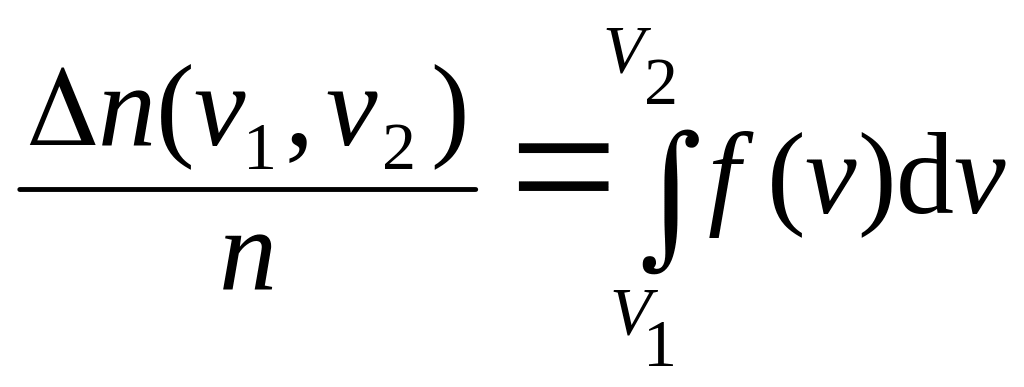 .
.
Нормированность:
![]() .
.
Вычисление среднего от любой функции скорости (v):
(v)
=
![]() .
.
Между тремя функциями распределения существует следующие связи:
(v)
= (v)4v2,
![]()
Функция
является четной функцией, то есть можно
написать:
= (v![]() ).
).
Функция
(
)
зависит только от v2
= vx2
+
vy2
+
vz2.
Связь между
и
удовлетворяется только функцией
![]() .
Коэффициенты А
и
определяются из двух условий а) нормировки
функции ,
б) требования, чтобы
vx2
=
,
v2
=
.
Коэффициенты А
и
определяются из двух условий а) нормировки
функции ,
б) требования, чтобы
vx2
=
,
v2
=
![]() .
Ответ выглядит так:
.
Ответ выглядит так:
![]() =
=![]()
(v)
=
![]() 4v2.
4v2.
Обычно именно последнюю формулу называют распределением Максвелла (рис. 4.10).
Ф
Рис. 4.10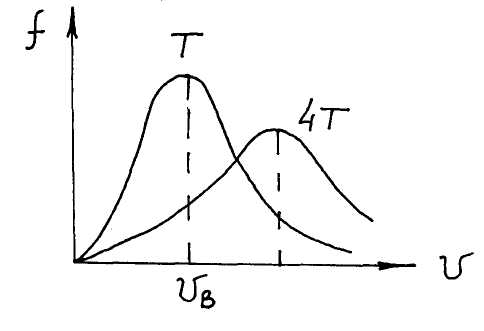
![]() ,
которую называют наиболее
вероятной скоростью.
Значение функции (v)
в этой точке равно
,
которую называют наиболее
вероятной скоростью.
Значение функции (v)
в этой точке равно
(vE)
= 4e![]()
![]() .
.
Например, при увеличении Т в 4 раза максимальная скорость станет в 2 раза больше, а соответствующее значение функции (vE) – в 2 раза меньше, но площадь под кривой, в данном случае равная единице, не изменится.
Средняя (или среднеарифметическая) скорость молекул вычисляется в соответствии с правилом:
v
=
![]() .
.
Распределение молекул по энергиям поступательного движения имеет вид:
()d
=
![]() .
.
Распределение Больцмана. Если газ находится во внешнем силовом поле, то концентрация молекул зависит от координат. Из условия механического равновесия газа можно получить:
n(
)
= n(
0)
exp
![]() ,
,
где
![]() (
)
– потенциальная энергия молекулы во
внешнем поле (распределение Больцмана).
Частным случаем распределения Больцмана
является барометрическая
формула:
(
)
– потенциальная энергия молекулы во
внешнем поле (распределение Больцмана).
Частным случаем распределения Больцмана
является барометрическая
формула:
n(h)
= n0exp(-![]() ,
p(h)
= n(h)kT
= p0exp(-
.
,
p(h)
= n(h)kT
= p0exp(-
.
Распределение
Максвелла-Больцмана.
Распределение Максвелла и распределение
Больцмана содержат выражение exp(-![]() ).
Распределение Максвелла-Больцмана
выражает вероятность того, что произвольная
молекула из объема содержащего N
молекул, находится в области пространства
(x,
x
+ dx;
y,
y
+ dy;
z,
z
+ dz)
и имеет скорость в интервале
(vx,
vx+
d
vx;
vy,
vy
+ dvy;
vz,
vz
+ dvz):
).
Распределение Максвелла-Больцмана
выражает вероятность того, что произвольная
молекула из объема содержащего N
молекул, находится в области пространства
(x,
x
+ dx;
y,
y
+ dy;
z,
z
+ dz)
и имеет скорость в интервале
(vx,
vx+
d
vx;
vy,
vy
+ dvy;
vz,
vz
+ dvz):
![]() =
dn(
)
=
dn(
)![]() .
.
Здесь
d³
=
dxdydz,
d³
=
dvxdvydvz,
=
+ ![]() (
)
– механическая энергия молекулы, А
– коэффициент, который можно найти из
условия нормировки. Общее распределение
Максвелла-Больцмана применимо к любым
видам энергии молекулы: энергии вращения,
энергии колебаний, потенциальной
энергии, зависящей от ориентации молекул,
и так далее.
(
)
– механическая энергия молекулы, А
– коэффициент, который можно найти из
условия нормировки. Общее распределение
Максвелла-Больцмана применимо к любым
видам энергии молекулы: энергии вращения,
энергии колебаний, потенциальной
энергии, зависящей от ориентации молекул,
и так далее.
