
- •Часть 1
- •О главление
- •Предисловие
- •После изучения дисциплины необходимо знать
- •После изучения дисциплины необходимо уметь
- •Содержание дисциплины
- •Самостоятельная работа студентов и контроль знаний студентов
- •После изучения главы необходимо знать
- •Простейшие интегралы
- •После изучения главы необходимо знать
- •2 Рис. 2.1 Рис. 2.1 .1. Кинематика материальной точки
- •Примеры решения задач
- •2.2. Кинематика абсолютно твердого тела
- •Примеры решения задач
- •2.3. Динамика материальной точки
- •Примеры решения задач
- •2.4. Законы сохранения
- •Примеры решения задач
- •2.5. Динамика абсолютно твердого тела
- •Примеры решения задач
- •2.6. Механика деформируемых тел
- •2.7. Механика жидкостей и газов
- •М етоды определения вязкости.
- •2.8. Неинерциальные системы отсчета
- •Пример решения задачи
- •2.9. Специальная теория относительности
- •Примеры решения задач
- •После изучения главы необходимо знать
- •3.1. Гармонические колебания
- •3.2. Свободные незатухающие механические колебания
- •С другой стороны, при малых углах
- •3.3. Затухающие механические колебания
- •3.4. Вынужденные механические колебания. Резонанс
- •3.5. Упругие волны
- •После изучения главы необходимо знать
- •4.1. Основные положения и определения
- •4.2. Уравнение состояния идеального газа
- •4.3. Внутренняя энергия и теплоемкость идеального газа
- •4.4. Кинетическая теория идеального газа
- •4.5. Реальные газы
- •Вопросы для самоконтроля к разделу 1: Элементы векторного анализа
- •К разделу 2: Физические основы механики
- •К разделу 3: Колебания и волны
- •К разделу 4: Молекулярная физика и термодинамика
- •Т олковый словарь
- •Инертность тел – свойство, присущее всем телам и заключающееся в том, что тела оказывают сопротивление изменению их скорости (как по модулю, так и по направлению).
- •Кинематика – раздел механики, изучающий движение тел без рассмотрения причин, которые это движение обуславливают.
- •З аключение
- •Б иблиографический список
- •Краткий курс физики
- •Часть 1
- •394026 Воронеж, Московский просп.,14
После изучения главы необходимо знать
Основные положения и определения молекулярно-кинетической теории и термодинамики. Опытное обоснование молекулярно-кинетической теории.
Газовые законы. Основное уравнение молекулярно-кинетической теории идеального газа.
Распределения Максвелла и Больцмана.
Явления переноса.
Понятие термодинамической системы. Число степеней свободы. Закон равномерного распределения энергии по степеням свободы.
Понятие о внутренней энергии системы. Теплоемкость. Работа в термодинамике.
Первое начало термодинамики и его применение к изопроцессам. Адиабатический процесс.
Круговой процесс. Обратимые и необратимые процессы. Цикл Карно. Тепловые двигатели.
Энтропия системы. Закон возрастания энтропии.
Реальные газы. Уравнения и изотермы Ван-дер-Ваальса. Внутренняя энергия реального газа.
Свойства жидкостей.
Твердые тела. Дефекты в кристаллах. Фазовые переходы.
4.1. Основные положения и определения
Молекулярная физика – это раздел физики, посвященный изучению макроскопических свойств твердых, жидких и газообразных тел на основе статистического метода, опирающегося на основные положения молекулярно – кинетической теории:
1. Все тела состоят из огромного числа мельчайших структурных элементов вещества – атомов и молекул.
2. Молекулы вещества находятся в непрерывном хаотическом движении.
3. Молекулы взаимодействуют между собой, притягиваясь на больших расстояниях и отталкиваясь на малых расстояниях.
Термодинамика – это раздел физики, посвященный изучению макроскопических свойств твердых, жидких и газообразных тел с энергетической точки зрения на основе термодинамического метода, заключающегося в установлении связей и соотношений между экспериментально определяемыми термодинамическими параметрами.
Количество вещества. Количество вещества в системе, то есть число содержащихся в ней структурных единиц – атомов и молекул, измеряется в молях. Моль любого вещества содержит определенное число молекул, называемое числом Авогадро, равное числу атомов в 12 г углерода:
NА = 6,02213·10²³ моль‾ ¹.
Для числа молей получим:
=
![]() =
=
![]() ,
,
где N – число молекул в системе, m = m0N = – масса системы или любого количества вещества (m0 – масса одной молекулы), = m0NA – молярная масса вещества. Единица молярной массы – килограмм на моль (кг/моль). Моль газа при нормальных условиях занимает объем:
V0 = 22,4·10‾ ³ м³.
Следовательно, в 1 м³ любого газа при нормальных условиях содержится одинаковое число молекул:
NЛ
=
![]() =
6,02213·10²³ моль‾ ¹ / 22,4·10 ‾ ³ моль‾ ¹ м³
= 2,7·10
=
6,02213·10²³ моль‾ ¹ / 22,4·10 ‾ ³ моль‾ ¹ м³
= 2,7·10![]() м‾ ³,
м‾ ³,
н
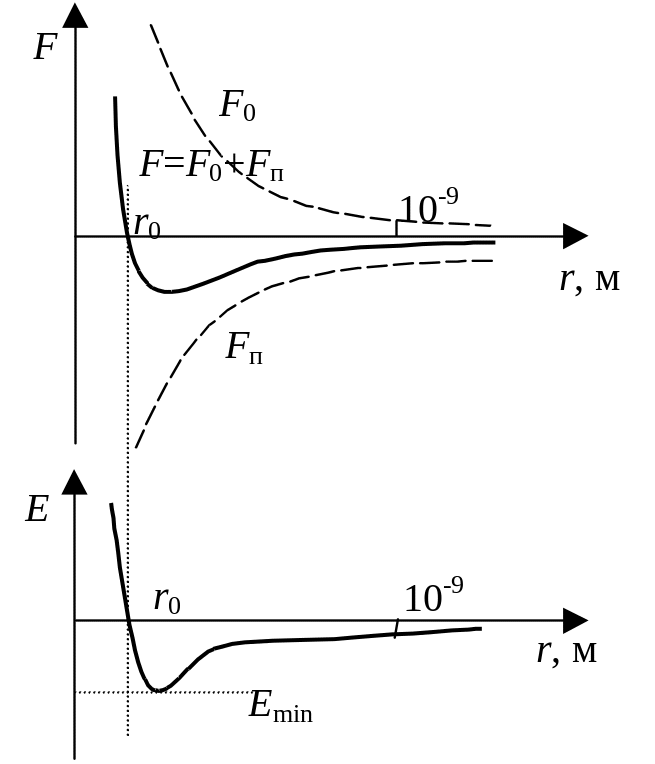
Силы и энергия межмолекулярного взаимодействия. Межмолекулярное взаимодействие – это взаимодействие электрически нейтральных молекул и атомов. Силы взаимодействия зависят от расстояния между молекулами (рис. 4.1).
Между молекулами силы притяжения и отталкивания действуют одновременно. На расстоянии r = r0 результирующая сила равна нулю, то есть силы притяжения уравновешивают силы отталкивания. Этому соответствует наиболее устойчивое расположение взаимодействующих молекул. При r > r0 силы притяжения превосходят силу отталкивания, при r < r0 - наоборот.
В
Рис. 4.1![]() .
Атомы и молекулы находятся в движении
и, следовательно, обладают кинетической
энергией. Соотношение между минимальной
потенциальной энергией Еп
и средней кинетической энергией Ек
хаотического теплового движения
определяет возможность существования
того или иного агрегатного состояния
вещества:
.
Атомы и молекулы находятся в движении
и, следовательно, обладают кинетической
энергией. Соотношение между минимальной
потенциальной энергией Еп
и средней кинетической энергией Ек
хаотического теплового движения
определяет возможность существования
того или иного агрегатного состояния
вещества:
при Ек Еп вещество находится в газообразном состоянии;
при Ек Еп вещество находится в твердом состоянии;
при Ек ≈ Еп вещество находится в жидком состоянии.
