
- •Часть 1
- •О главление
- •Предисловие
- •После изучения дисциплины необходимо знать
- •После изучения дисциплины необходимо уметь
- •Содержание дисциплины
- •Самостоятельная работа студентов и контроль знаний студентов
- •После изучения главы необходимо знать
- •Простейшие интегралы
- •После изучения главы необходимо знать
- •2 Рис. 2.1 Рис. 2.1 .1. Кинематика материальной точки
- •Примеры решения задач
- •2.2. Кинематика абсолютно твердого тела
- •Примеры решения задач
- •2.3. Динамика материальной точки
- •Примеры решения задач
- •2.4. Законы сохранения
- •Примеры решения задач
- •2.5. Динамика абсолютно твердого тела
- •Примеры решения задач
- •2.6. Механика деформируемых тел
- •2.7. Механика жидкостей и газов
- •М етоды определения вязкости.
- •2.8. Неинерциальные системы отсчета
- •Пример решения задачи
- •2.9. Специальная теория относительности
- •Примеры решения задач
- •После изучения главы необходимо знать
- •3.1. Гармонические колебания
- •3.2. Свободные незатухающие механические колебания
- •С другой стороны, при малых углах
- •3.3. Затухающие механические колебания
- •3.4. Вынужденные механические колебания. Резонанс
- •3.5. Упругие волны
- •После изучения главы необходимо знать
- •4.1. Основные положения и определения
- •4.2. Уравнение состояния идеального газа
- •4.3. Внутренняя энергия и теплоемкость идеального газа
- •4.4. Кинетическая теория идеального газа
- •4.5. Реальные газы
- •Вопросы для самоконтроля к разделу 1: Элементы векторного анализа
- •К разделу 2: Физические основы механики
- •К разделу 3: Колебания и волны
- •К разделу 4: Молекулярная физика и термодинамика
- •Т олковый словарь
- •Инертность тел – свойство, присущее всем телам и заключающееся в том, что тела оказывают сопротивление изменению их скорости (как по модулю, так и по направлению).
- •Кинематика – раздел механики, изучающий движение тел без рассмотрения причин, которые это движение обуславливают.
- •З аключение
- •Б иблиографический список
- •Краткий курс физики
- •Часть 1
- •394026 Воронеж, Московский просп.,14
4.3. Внутренняя энергия и теплоемкость идеального газа
В отличие от механической энергии, которая может изменяться только за счет работы, внутренняя энергия может изменяться как за счет работы, так в процессе теплообмена. Энергия, переданная при теплообмене, называется количеством теплоты и обозначается Q. Теплота считается положительной, если система получает энергию, и отрицательной, если отдает.
С точки зрения классической молекулярно-кинетической теории, внутренняя энергия термодинамической системы равна сумме кинетической энергии движения ее молекул и потенциальной энергии их взаимодействия. Внутренняя энергия U = U(V, T) – функция состояния термодинамической системы, она является важнейшей характеристикой термодинамической системы.
Первое начало термодинамики. Изменение полной энергии системы ∆Е = ∆Емех + ∆U (где ∆Емех - изменение механической энергии, ∆U - изменение внутренней энергии) равно работе внешних сил Авнешн и теплоте Q, полученной при теплообмене с внешними телами:
∆Емех + ∆U = Авнешн+ Q.
Иногда закон сохранения энергии, выраженный данным соотношением, формулируют как невозможность создания вечного двигателя первого рода (который производил бы работу из ничего). Первым началом термодинамики называют применение закона сохранения к термодинамической системе, механическая энергия которой не меняется ∆Емех= 0. Если обозначить работу против внешних сил как А = - Авнешн, то получим уравнение
Q = ∆U + А,
которое приводит к несколько иной формулировке первого начала термодинамики: подведенная к системе теплота Q идет на изменение внутренней энергии системы ∆U и на совершение системой работы А против внешних сил.
Если простая термодинамическая система получила бесконечно малое количество теплоты, то имеем
Q = dU + А.
Отношение Q к изменению температуры dТ называют теплоемкостью системы С (Дж/К), которая показывает какое количество теплоты нужно сообщить системе для повышения ее температуры на 1К:
СdТ = dU + pdV.
Считая внутреннюю энергию функцией двух переменных U = U(V, Т), запишем
dU
=
![]() dT
+
dT
+
![]() dV
= C
dT
+
dV,
dV
= C
dT
+
dV,
где C = – теплоемкость при постоянном объеме. Получаем:
СdT = C dT + [р + ]dV.
Отсюда
видно, что теплоемкость для процесса
V(Т)
зависит от значения производной
![]() .
Так как параметры (V,Т)
можно менять независимо, то эта
производная, а значит, и теплоемкость
в данной точке может иметь любое значение.
.
Так как параметры (V,Т)
можно менять независимо, то эта
производная, а значит, и теплоемкость
в данной точке может иметь любое значение.
Энтальпия. Если равновесный процесс изменения состояния происходит при постоянном давлении, то подведенная теплота
Q = ∆U + p∆V = ∆(U + pV) = ∆Н (р = const)
равна разности энтальпии (теплосодержание). Энтальпия - это термодинамический потенциал, характеризующий состояние равновесной системы: Н = U + pV в конечном и начальном состоянии.
Тепловые процессы в идеальном газе. Внутренняя энергия идеального газа зависит только от его температуры. Экспериментально установленно, что температура идеального газа не меняется в течение процесса Джоуля-Томпсона – процесса, заключаюшегося в медленном протекании газа (расширении) под действием постоянного перепада давления сквозь пористую перегородку в условиях внешней энергетической изоляции. Такое расширение идеального газа не меняет его внутренней энергии, то есть = 0. Получается, что изменение внутренней энергии и первое начало термодинамики для идеального газа описываются соотношениями вида:
dU = C dT, Q = C dT + pdV.
В широких пределах изменения температуры также экспериментально установлено, что теплоемкость C не зависит от Т, и можно записать U = C dT + const.
Рассмотрим конкретные процессы.
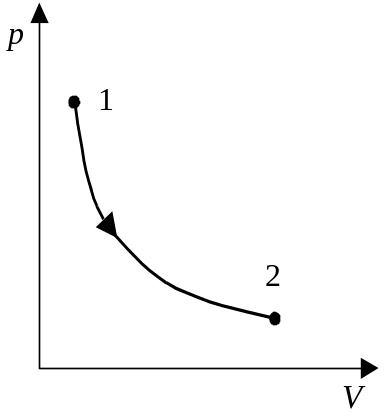 1.
Изотермический процесс
(dT
= 0) (рис. 4.6).
1.
Изотермический процесс
(dT
= 0) (рис. 4.6).
В этом случае dU = 0, то есть
Q
= pdV,
Q
= А
=![]() p(V)dV
= RTln
p(V)dV
= RTln![]() .
.
Теплоемкость данного процесса можно считать равной бесконечности.
2
Рис. 4.6
СрdT = CvdT + pdV = CvdT + RdT.
С окращая
на dT,
получим соотношение между теплоемкостями
(уравнение Майера):
окращая
на dT,
получим соотношение между теплоемкостями
(уравнение Майера):
С![]() =
C
+ R,
С
=
C
+ R,
С![]() =
C
=
C![]() +
R,
с
=
c
+
+
R,
с
=
c
+
![]() .
.
где
с
=
![]() – удельная теплоемкость, С
– удельная теплоемкость, С![]() =
=![]() - молярная теплоемкость газа (измеряется
в Дж/(кг·К) и Дж/(мол·К) соответственно).
- молярная теплоемкость газа (измеряется
в Дж/(кг·К) и Дж/(мол·К) соответственно).
3. Адиабатический процесс. Если равновесный процесс происходит без подвода тепла (Q = 0), то
С
Рис. 4.7![]() dV
dV
![]() = -
= -![]() ·
·![]() .
.
Интегрируя,
получим уравнение адиабатического
процесса (уравнение Пуассона): ТV![]() = const
или pV
= const
или pV![]() = const,
где безразмерный параметр
=
= const,
где безразмерный параметр
=
![]() = 1 +
называется показателем
адиабаты.
Через ,
с учетом уравнения Майера, можно выразить
теплоемкость газа:
= 1 +
называется показателем
адиабаты.
Через ,
с учетом уравнения Майера, можно выразить
теплоемкость газа:
C
=
![]() ,
С
=
,
С
=
![]() .
.
Очевидно, что по величине С > С . Наряду с теплоемкостями является важной тепловой характеристикой газа и определяется на практике многими способами (например, методом адиабатического расширения – метод Клемана-Дезорма). Так как непосредственное измерение теплоемкостей С и С экспериментально затруднительно из-за их ничтожной доли по-сравнению с теплоемкостью сосуда, то проще измерить отношение этих величин .
4. Политропный процесс. Политропным называется процесс, теплоемкость которого постоянна (С = const):
СdT = C dT + pdV (C – С)dT = - pdV.
Проведя такие же вычисления, как для адиабатического процесса, получим уравнение политропного процесса:
р
![]() = const,
= const,
где
n
= 1 +
![]() =
=
![]() – показатель политропы.
– показатель политропы.
5
Рис. 4.8
=
![]() =
=
![]() = 1 –
= 1 –
![]() ,
,
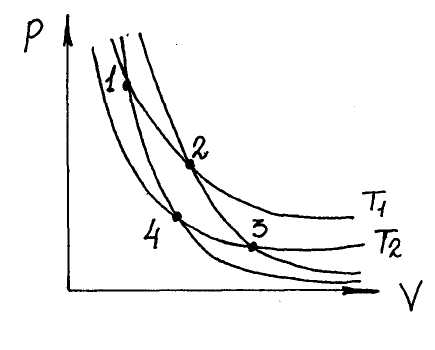
где А – работа за цикл, Q1 – теплота, полученная от нагревателя, Q2 – теплота, отданная холодильнику. В замкнутом цикле ∆U = 0, поэтому Q1 – Q2 = А.
Для цикла Карно можно вывести следующие соотношения:
Q1
= RТ1ln
,
Q
= RТ2ln![]() .
.
Из уравнения Пуассона находим:
Т1V1 = Т2V4-1 и Т1V2 = Т2V3-1 .
Отсюда
следует, что
![]() .
Поэтому для КПД газовой машины Карно
получим выражение:
.
Поэтому для КПД газовой машины Карно
получим выражение:
=
1 -
![]() ,
,
то есть КПД цикла Карно зависит только от отношения температур холодильника и нагревателя. Теорема Карно утверждает, что КПД произвольного цикла Карно не может превышать КПД обратимого цикла Карно, работающего при тех же T1 и T2. Из этого следует, что КПД обратимого цикла Карно не зависит от природы рабочего тела.
Теорему Карно можно записать в виде:
![]() или
или
![]() ,
,
причем равенство соответствует обратимому циклу Карно.
Второе начало термодинамики. Второе начало термодинамики можно сформулировать двумя наиболее известными способами:
Формулировка Томсона. Невозможен процесс, единственным результатом которого было бы совершение работы за счет теплоты, взятой у теплового резервуара при постоянной температуре. Эта же формулировка, но выраженная другими словами, утверждает невозможность создания вечного двигателя второго рода (то есть производящего работу за счет внутренней энергии теплового резервуара).
Формулировка Клаузиуса. Невозможен процесс, единственным результатом которого была бы передача энергии от более холодного тела к более горячему. Формулировки Томсона и Клаузиуса эквивалентны.
Второе начало термодинамики позволяет вывести важное соотношение для внутренней энергии простой термодинамической системы, которое не может быть получено в рамках первого начала:
![]() .
.
Неравенство Клаузиуса. Если в замкнутом цикле система получает количества теплоты Q1, , QN от внешних резервуаров, имеющих температуры Т1, , ТN, то удовлетворяется неравенство
![]() или
или
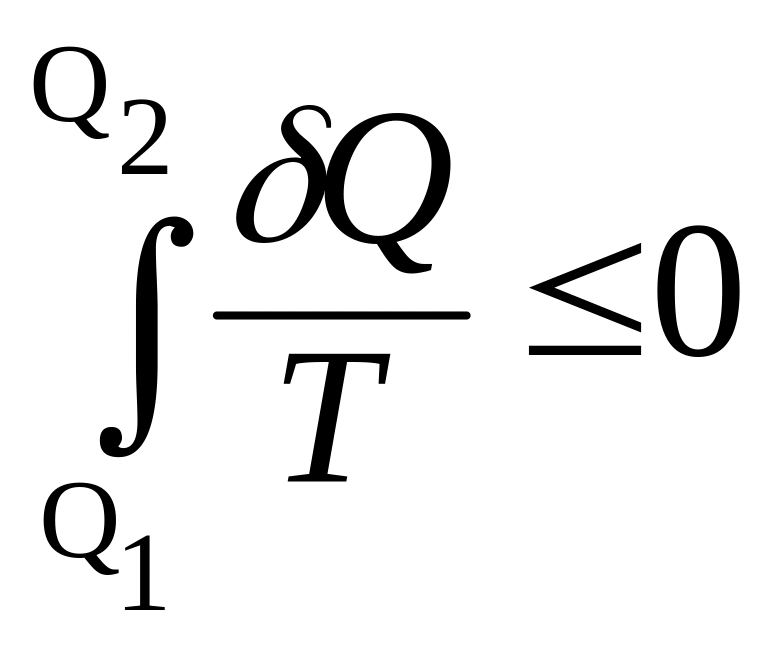 ,
,
Для обратимого процесса неравенство превращается в равенство, а температура резервуара, с которым система в данной точке цикла обменивается теплом, равна температуре системы. В этом случае получим
![]() .
.
Равенство (уравнение Клаузиуса) служит основой для еще одной функции состояния термодинамической системы – энтропии.
Энтропия. Энтропия является понятием, введенным в термодинамику для определения меры необратимого рассеяния энергии. Энтропия S – функция состояния термодинамической системы, характеризующая направление протекания теплообмена между системой и внешней средой, а также направление протекания самопроизвольных процессов в замкнутой системе.
В общем виде разность энтропий в двух состояниях 1 и 2 системы для обратимого процесса можно определить как
![]() .
.
Для
нахождения величины энтропии в конкретном
состоянии 1 при Т![]() 0
(используя теорему Нернста (см. далее):
при абсолютном нуле температуры энтропия
системы равна нулю) интеграл берется
вдоль пути, соответствующего обратимому
процессу, начинающемуся состоянием 0
при Т
= 0 и заканчивающемуся состоянием 1, что
записывается как
0
(используя теорему Нернста (см. далее):
при абсолютном нуле температуры энтропия
системы равна нулю) интеграл берется
вдоль пути, соответствующего обратимому
процессу, начинающемуся состоянием 0
при Т
= 0 и заканчивающемуся состоянием 1, что
записывается как
S1
=![]() .
.
В изолированной системе (нет подвода тепла) все обратимые процессы протекают так, что энтропия остается постоянной dS = 0. Необратимые процессы протекают в сторону увеличения энтропии.
Рассмотрим неравновесный процесс, переводящий систему из равновесного состояния 1 в равновесное состояние 2. Организуем циклический процесс, вернувшись из 2 в 1 при помощи любого равновесного процесса. Запишем для этого цикла неравенство Клаузиуса и для равновесного процесса учтем определение энтропии. Получим:
![]() .
.
Если
неравновесный процесс происходит в
условиях адиабатического процесса (без
подвода тепла), то левая часть равенства
обращается в нуль, что дает S2
![]() S2,
то есть в любом процессе без подвода
тепла энтропия не убывает. Равновесное
состояние теплоизолированной сисстемы
соответствует максимуму энтропии и
является наиболее вероятным, поэтому
все самопроизвольные процессы в системе
направлены в сторону увеличения энтропии
S.
S2,
то есть в любом процессе без подвода
тепла энтропия не убывает. Равновесное
состояние теплоизолированной сисстемы
соответствует максимуму энтропии и
является наиболее вероятным, поэтому
все самопроизвольные процессы в системе
направлены в сторону увеличения энтропии
S.
Формула Больцмана. Понятия энтропии и вероятности какого-то состояния имеют много общего. Формула Больцмана S = kln, где k – постоянная Больцмана, связывает энтропию макроскопического состояния со статистическим весом этого состояния, то есть числом различных микроскопических состояний, которые его реализуют. Назовем микроскопическим состоянием системы определенное распределение молекул газа по координатам и скоростям. Число микросостояний, соответствующих данному макросостоянию системы, называют термодинамической вероятностью . Чем больше , тем больше вероятность состояния. При неравновесных процессах система переходит от менее вероятного к более вероятным состояниям. Логарифм обеспечивает адитивность энтропии: статистический вес системы, состоящей из двух независимых подсистем, равен произведению их статистических весов. Энтропия характеризует меру беспорядочности теплового движения молекул.
Третье начало термодинамики. Третье начало термодинамики (теорема Нернста) утверждает, что при приближении температуры к абсолютному нулю энтропия любой системы стремится к определенному конечному значению, не зависящему от значения остальных термодинамических параметров. Энтропию системы при Т = 0 принимают равной нулю. Статистическое объяснение сводится к следующему: при Т = 0 система находится в наинизшем энергетическом состоянии, кратность которого (равная статистическому весу системы при Т = 0) невелика, и в соответствии с формулой Больцмана S = kln энтропия пренебрежимо мала. Следствиями третьего начала термодинамики можно считать утверждения: при Т 0 теплоемкость C и C системы, а также ее температурные коэффициенты объемного расширения и давления стремятся к нулю.
Примеры решения задач
Пример 1.
Какую работу надо совершить для
равномерного изотермического раздувания
мыльного пузыря от R1 до R2
при наружном давлении р![]() ?
?
Решение: Искомая
работа складывается из работы против
внешнего давления А![]() и
работы по изотермическому увеличению
пленки А
и
работы по изотермическому увеличению
пленки А![]() ,
и поэтому можно записать, что
,
и поэтому можно записать, что
А = А![]() =
р
=
р
![]() =
р
=
р
![]() .
.
Пример 2. Сколько тепла выделится при превращении в жидкость насыщающего пара, если температура среды постоянна и равна Т, а начальный объем пара V?
Решение:
Очевидно, Q =
![]() ,
где р – давление насыщающего пара
при температуре конденсации Т.
Поскольку
,
где р – давление насыщающего пара
при температуре конденсации Т.
Поскольку
![]() (весь
пар конденсировался) и
(весь
пар конденсировался) и
![]() ,
то с учетом того, что по уравнению
Клапейрона-Менделеева
,
то с учетом того, что по уравнению
Клапейрона-Менделеева
![]() ,
имеем
,
имеем
![]() .
.
Объем жидкости
V![]() ,
получившейся при конденсации пара,
находится по формуле
,
получившейся при конденсации пара,
находится по формуле
![]() .
.
Так как m![]() ,
а m
,
а m![]() ,
то
,
то
![]() ,
что при подстановке дает выражение
,
что при подстановке дает выражение
![]() {-r
{-r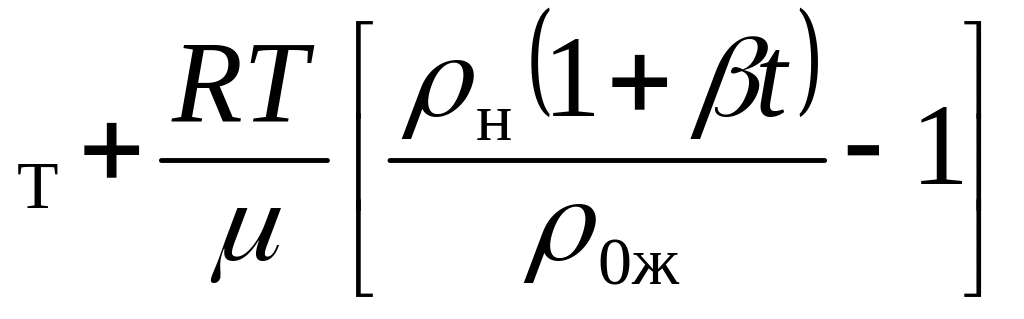 }.
Видно, что Q < 0, так как
}.
Видно, что Q < 0, так как
![]() <
<
![]() ,
то есть идет выделение тепла.
,
то есть идет выделение тепла.
