
- •Часть 1
- •О главление
- •Предисловие
- •После изучения дисциплины необходимо знать
- •После изучения дисциплины необходимо уметь
- •Содержание дисциплины
- •Самостоятельная работа студентов и контроль знаний студентов
- •После изучения главы необходимо знать
- •Простейшие интегралы
- •После изучения главы необходимо знать
- •2 Рис. 2.1 Рис. 2.1 .1. Кинематика материальной точки
- •Примеры решения задач
- •2.2. Кинематика абсолютно твердого тела
- •Примеры решения задач
- •2.3. Динамика материальной точки
- •Примеры решения задач
- •2.4. Законы сохранения
- •Примеры решения задач
- •2.5. Динамика абсолютно твердого тела
- •Примеры решения задач
- •2.6. Механика деформируемых тел
- •2.7. Механика жидкостей и газов
- •М етоды определения вязкости.
- •2.8. Неинерциальные системы отсчета
- •Пример решения задачи
- •2.9. Специальная теория относительности
- •Примеры решения задач
- •После изучения главы необходимо знать
- •3.1. Гармонические колебания
- •3.2. Свободные незатухающие механические колебания
- •С другой стороны, при малых углах
- •3.3. Затухающие механические колебания
- •3.4. Вынужденные механические колебания. Резонанс
- •3.5. Упругие волны
- •После изучения главы необходимо знать
- •4.1. Основные положения и определения
- •4.2. Уравнение состояния идеального газа
- •4.3. Внутренняя энергия и теплоемкость идеального газа
- •4.4. Кинетическая теория идеального газа
- •4.5. Реальные газы
- •Вопросы для самоконтроля к разделу 1: Элементы векторного анализа
- •К разделу 2: Физические основы механики
- •К разделу 3: Колебания и волны
- •К разделу 4: Молекулярная физика и термодинамика
- •Т олковый словарь
- •Инертность тел – свойство, присущее всем телам и заключающееся в том, что тела оказывают сопротивление изменению их скорости (как по модулю, так и по направлению).
- •Кинематика – раздел механики, изучающий движение тел без рассмотрения причин, которые это движение обуславливают.
- •З аключение
- •Б иблиографический список
- •Краткий курс физики
- •Часть 1
- •394026 Воронеж, Московский просп.,14
4.5. Реальные газы
 При рассмотрении
реальных газов необходимо учитывать
собственный объем молекул и силы
межмолекулярного взаимодействия.
При рассмотрении
реальных газов необходимо учитывать
собственный объем молекул и силы
межмолекулярного взаимодействия.
Уравнение Ван-дер-Ваальса
Внесем в уравнение состояния идеального газа pV=RT поправки, приняв во внимание вышеуказанный факт.
Ф
Рис. 4.11
Учет сил
межмолекулярного притяжения осуществляется
введением дополнительного давления
pвнутр на газ,
называемого внутренним давлением:
![]() ,
где a – постоянная
Ван-дер-Ваальса.
,
где a – постоянная
Ван-дер-Ваальса.
Уравнение
Ван-дер-Ваальса для моля газа –
уравнение состояния реальных газов:
![]() Для произвольной массы газа:
Для произвольной массы газа:
![]() где
где
![]()
![]()
И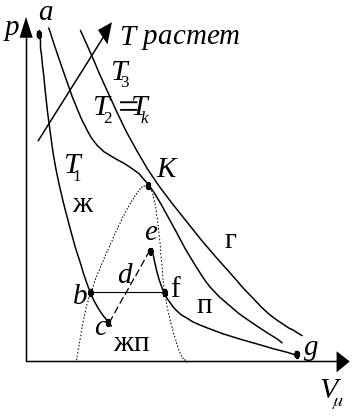 зотермы
реальных газов.
зотермы
реальных газов.
Изотерма реального газа (Рис. 4.12) представляет собой зависимость молярного объема газа от давления при постоянной температуре.
При высоких температурах (T > Tk) изотерма реального газа отличается от изотермы идеального газа только искажением формы.
При некоторой температуре Tk – критической температурой – на изотерме появляется
Т
Рис. 4.12
При T < Tk уравнению Ван-дер-Ваальса соответствует кривая a-b-c-d-e-f-g. Однако, на участке e-c сжатие вещества сопровождается уменьшением давления, следовательно в этой области вещество распадается на две фазы – жидкость и пар.
Фаза – совокупность всех частей системы, обладающих одинаковым химическим составом и находящихся в одинаковом термодинамическом состоянии.
Истинные докритические изотермы реального газа имеют вид a-b-f-g и являются кривыми непрерывного перехода вещества из газообразного состояния (г) (участок f-g) в жидкое (ж) (участок b-a). Участок f-b соответствует равновесному сосуществованию жидкости и газа.
Вещество в газообразном состоянии при температуре ниже критической называется паром(п), а пар, находящийся в равновесии со своей жидкостью, называется насыщенный(жп). Пар при изотермическом сжатии претерпевает процесс сжижения. Газ при температурах T > Tk не может быть превращен в жидкость ни при каком давлении(г).
При некоторых условиях могут быть реализованы метастабильные состояния e-f и b-c. Участок b-c изображает перегретую жидкость, e-f –пересыщенный пар.
Внутренняя энергия реального газа.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения молекул (CVT) и потенциальной энергии межмолекулярного взаимодействия (-a/V):
![]()
Если газ расширяется без теплообмена с окружающей средой (адиабатически, т.е. Q = 0) и не совершает работы ( так называемое расширение газа в вакуум, т.е. A = 0), из первого начала термодинамики (Q = (U2 - U1) + A) следует, что: U1 = U2.
При адиабатическом расширении без совершения внешней работы внутренняя энергия газа не меняется.
Для идеального газа это означает, что T1 = T2 (температура не изменятся).
Для реального газа
U = CVT
- a/V, поэтому
![]()
Реальный газ при адиабатическом расширении в вакуум охлаждается.
