
- •Часть 1
- •О главление
- •Предисловие
- •После изучения дисциплины необходимо знать
- •После изучения дисциплины необходимо уметь
- •Содержание дисциплины
- •Самостоятельная работа студентов и контроль знаний студентов
- •После изучения главы необходимо знать
- •Простейшие интегралы
- •После изучения главы необходимо знать
- •2 Рис. 2.1 Рис. 2.1 .1. Кинематика материальной точки
- •Примеры решения задач
- •2.2. Кинематика абсолютно твердого тела
- •Примеры решения задач
- •2.3. Динамика материальной точки
- •Примеры решения задач
- •2.4. Законы сохранения
- •Примеры решения задач
- •2.5. Динамика абсолютно твердого тела
- •Примеры решения задач
- •2.6. Механика деформируемых тел
- •2.7. Механика жидкостей и газов
- •М етоды определения вязкости.
- •2.8. Неинерциальные системы отсчета
- •Пример решения задачи
- •2.9. Специальная теория относительности
- •Примеры решения задач
- •После изучения главы необходимо знать
- •3.1. Гармонические колебания
- •3.2. Свободные незатухающие механические колебания
- •С другой стороны, при малых углах
- •3.3. Затухающие механические колебания
- •3.4. Вынужденные механические колебания. Резонанс
- •3.5. Упругие волны
- •После изучения главы необходимо знать
- •4.1. Основные положения и определения
- •4.2. Уравнение состояния идеального газа
- •4.3. Внутренняя энергия и теплоемкость идеального газа
- •4.4. Кинетическая теория идеального газа
- •4.5. Реальные газы
- •Вопросы для самоконтроля к разделу 1: Элементы векторного анализа
- •К разделу 2: Физические основы механики
- •К разделу 3: Колебания и волны
- •К разделу 4: Молекулярная физика и термодинамика
- •Т олковый словарь
- •Инертность тел – свойство, присущее всем телам и заключающееся в том, что тела оказывают сопротивление изменению их скорости (как по модулю, так и по направлению).
- •Кинематика – раздел механики, изучающий движение тел без рассмотрения причин, которые это движение обуславливают.
- •З аключение
- •Б иблиографический список
- •Краткий курс физики
- •Часть 1
- •394026 Воронеж, Московский просп.,14
4.2. Уравнение состояния идеального газа
Идеальным называют такой газ, для которого можно пренебречь размерами молекул, силами межмолекулярного взаимодействия, и считать соударение молекул абсолютно упругим.
Состояние
некоторой массы m
газообразного вещества характеризуется
параметрами
состояния
(объемом V,
давлением p
=
![]() (1н/м² = 1Па), термодинамической температурой
T(К)
= 273,15 + t
(°С),
плотностью ρ,
молярной массой
и др.). Состояние называется равновесным
если параметры вещества определены и
не изменяются со временем. В неравновесном
состоянии хотя бы один параметр вещества
неопределен.
(1н/м² = 1Па), термодинамической температурой
T(К)
= 273,15 + t
(°С),
плотностью ρ,
молярной массой
и др.). Состояние называется равновесным
если параметры вещества определены и
не изменяются со временем. В неравновесном
состоянии хотя бы один параметр вещества
неопределен.
Между термодинамическими параметрами p, V, T существует однозначное соотношение, называемое уравнением состояния. Простейшее уравнение равновесного состояния газообразного вещества имеет вид: f(p, V, T) = 0.
П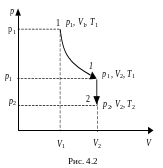 усть
некоторая масса газа занимает объем
V1, имеет давление
p1 и находится
при температуре Т1 (рис. 4.2).
Эта же масса газа в другом произвольном
состоянии характеризуется параметрами
p2, V2,
T2. Переход из
состояния 1 в состояние 2 осуществляется
последовательно изотермическим
(1-1) и изохорным
(1-2) процессами.
усть
некоторая масса газа занимает объем
V1, имеет давление
p1 и находится
при температуре Т1 (рис. 4.2).
Эта же масса газа в другом произвольном
состоянии характеризуется параметрами
p2, V2,
T2. Переход из
состояния 1 в состояние 2 осуществляется
последовательно изотермическим
(1-1) и изохорным
(1-2) процессами.
По законам Бойля-Мариотта и Шарля:
p1V1
= p1V2
![]()
Исключая p1, получим уравнение состояния идеального газа:
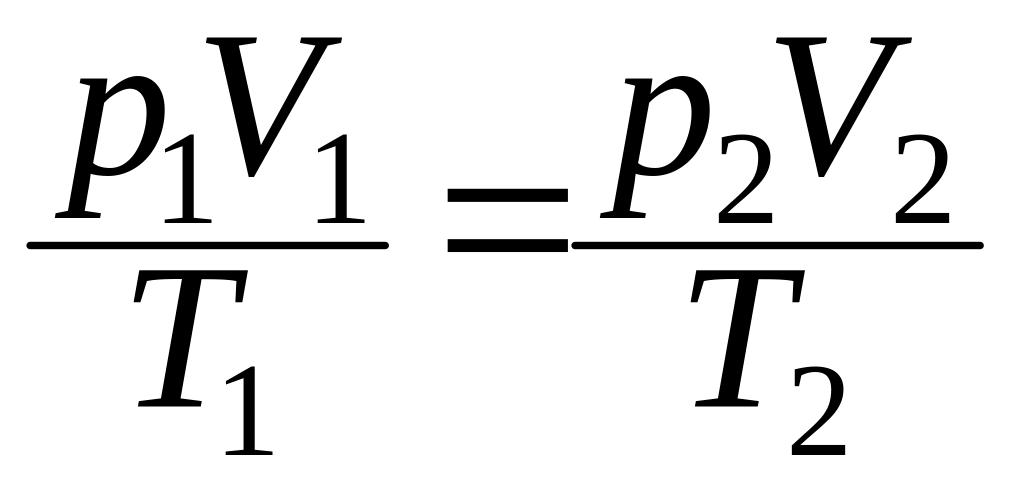 или
или
![]() .
.
Термодинамические
параметры равновесного состояния
идеального газа при m
= const
связаны уравнением
Клапейрона:
![]() = const.
= const.
При
T
= 273 К (t
= 0°С) и p
= 1,013·105
Па эмпирически установлено, что один
моль любого газа занимает объем V0
= 22,4·10‾ ³ м³, откуда можно найти числовое
значение молярной
(универсальной) газовой постоянной:
R
=
![]() = 8,31 Дж / (моль·К).
= 8,31 Дж / (моль·К).
Уравнение состояния для моля идеального газа можно записать в виде:
pV0 = RT.
Его
называют также уравнением
Клапейрона - Менделеева.
Уравнение Клапейрона -Менделеева для
любой массы газа m
(объемом V
=
![]() )
записывается как:
)
записывается как:
pV
= RT
=
![]() RT.
RT.
Величина
k
=
![]() = 1,38·10 ‾²³ Дж / К называется постоянной
Больцмана
и представляет собой газовую постоянную,
отнесенную к одной молекуле. При этом
уравнение состояния идеального газа
приводится к виду:
= 1,38·10 ‾²³ Дж / К называется постоянной
Больцмана
и представляет собой газовую постоянную,
отнесенную к одной молекуле. При этом
уравнение состояния идеального газа
приводится к виду:
pV
= RT
= N![]() T
= NkT
p
=
T
= NkT
p
=
![]() kT
= nkT,
kT
= nkT,
откуда получается, что давление газа пропорционально произведению числа молекул в единице объема n на его термодинамическую температуру. Если учесть, что плотность газа
ρ
=
![]() ,
а его масса m=
,
а его масса m=![]() ,
то можно выразить ρ
через термодинамические параметры:
,
то можно выразить ρ
через термодинамические параметры:
ρ
=
![]() .
.
Работа простой термодинамической системы. Однородная и изотропная термодинамическая система, химический состав которой не меняется, называется термодинамически простой (однокомпонентные (чистые) газы и жидкости). Равновесные состояния простой системы можно изображать точками на плоскости (например, в координатах (p, V)), равновесные процессы – линиями на плоскости. Работа, совершаемая простой системой против внешних сил, равна
А
= pdV,
A
=
![]() p(V)dV,
p(V)dV,
где p(V) называется уравнением процесса. Так как работа не является функцией состояния, то бесконечно малая работа обозначена А, чтобы отличить ее от бесконечно малого изменения функции (дифференциала).
Наличие
связи между любыми тремя параметрами
простой системы, налагаемое уравнением
состояния, приводит к связи между их
производными. Выразив Т
через изменения р
и V:
dТ
=
![]() dV
+
dV
+
![]() dp
и применив это выражение к изотермическому
процессу, для которого dТ
= 0, получим (
dp
и применив это выражение к изотермическому
процессу, для которого dТ
= 0, получим (![]() )p(
)p(![]() )V(
)V(![]() )T
= - 1. Это соотношение связывает между
собой три коэффициента:
)T
= - 1. Это соотношение связывает между
собой три коэффициента:
=
![]() (
)p
– температурный коэффициент объемного
расширения;
(
)p
– температурный коэффициент объемного
расширения;
Рис.
4.3
![]() (
(![]() )
)![]() – температурный коэффициент давления;
– температурный коэффициент давления;
К = - V( )T– изотермический модуль всестороннего сжатия.
Изопроцессы в идеальном газе. Термодинамический процесс, протекающий в газе, при котором один из параметров, определяющих состояние газа, остается постоянным, называется изопроцессом.
И
Рис.
4.4
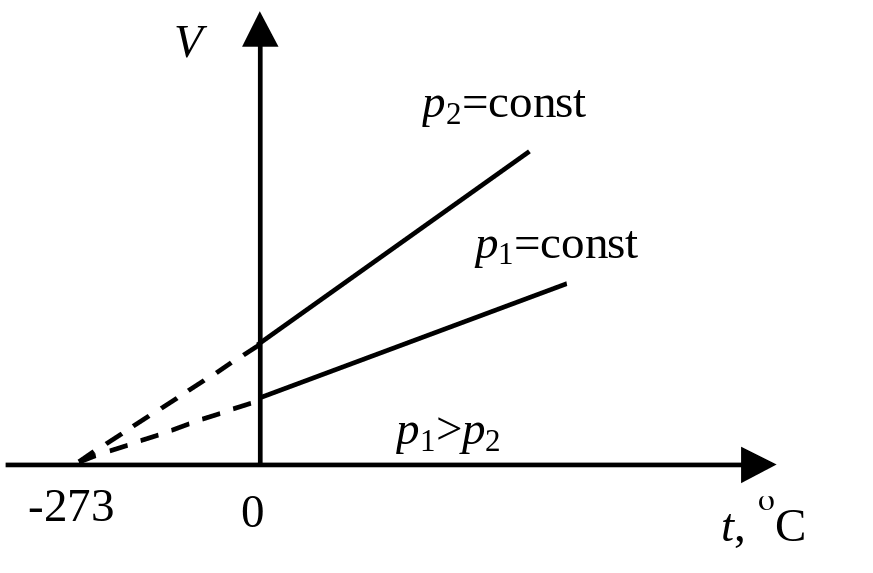 Рис.
4.4
Рис.
4.4
Изобарный процесс протекает при постоянном давлении (р = const). Объем газа данной массы при постоянном давлении возрастает линейно с увеличением температуры (закон Гей-Люссака): V = V0(1+ vt), где V – объем газа при температуре t,°С; V0 - объем газа при 0°С. Величина vt называется температурным коэффициентом объемного расширения. Графическая зависимость объема от температуры изображается прямой линией – изобарой (рис. 4.4).
И
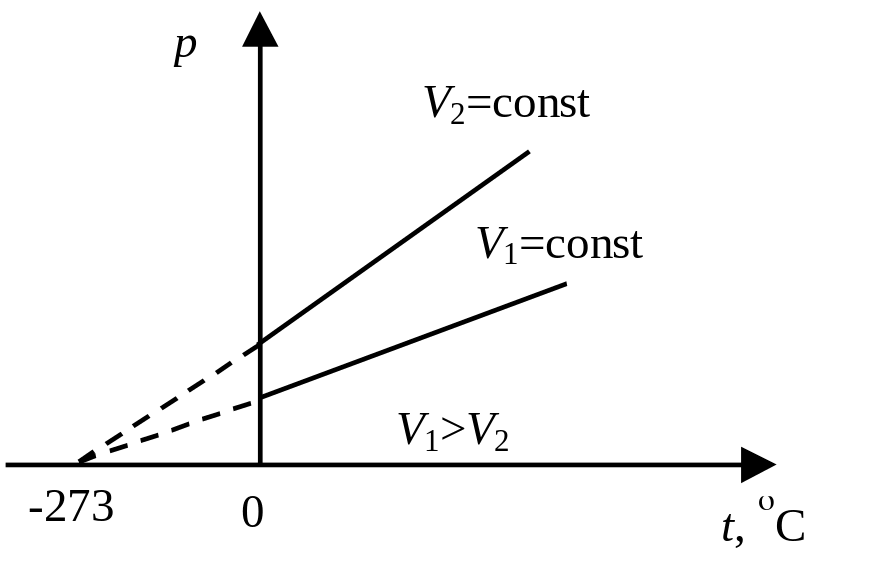 Рис.
4.5
Рис.
4.5![]() называется
температурным
коэффициентом давления.
Графическая зависимость давления от
температуры изображается прямой линией
– изохорой
(рис. 4.5).
называется
температурным
коэффициентом давления.
Графическая зависимость давления от
температуры изображается прямой линией
– изохорой
(рис. 4.5).
Значения температурных коэффициентов не зависят от природы газов и для всех газов их можно связать между собой следующим образом:
v
=
=
![]() .
.
Заменив в уравнениях изобары и изохоры температуру, отсчитанную по шкале Цельсия, термодинамической температурой T = 273,15 + t (°С), , получим:
рT
= р0[1+
(Т
–
![]() )]
= р0Т,
)]
= р0Т,
VT = V0[1+ (Т – )] = V0Т.
Примеры решения задач
Пример 1.
Наполненный газом бак в виде прямоугольного
параллелепипеда длиной l
и с площадью основания S движется
с ускорением а в направлении,
перпендикулярном одной из его стенок.
Плотность покоящегося газа 0,
его масса М, температура Т. Силой
тяжести, действующей на газ, пренебречь.
Найти разность плотностей (![]() )
у его задней и передней стенок.
)
у его задней и передней стенок.
Решение: Для
нахождения плотностей газа у задней
стенки![]() и у передней стенки
и у передней стенки![]() рассмотрим тонкие слои газа около
стенок, объемом dVз
и dVп
с массой газа в них dMз
и dMп,
соответственно, такие, чтобы в пределах
этих слоев плотность газа была практически
постоянной. Уравнения состояния для
слоев имеют вид
рассмотрим тонкие слои газа около
стенок, объемом dVз
и dVп
с массой газа в них dMз
и dMп,
соответственно, такие, чтобы в пределах
этих слоев плотность газа была практически
постоянной. Уравнения состояния для
слоев имеют вид
pз
=
![]() =
=
![]() ,
pп =
,
pп =
![]() =
=
![]() ,
,
откуда получается, что разность плотностей газа у стенок бака ( - ) зависит от разности давлений у стенок (pз - pп):
pз
- pп = (
-
)![]() -
=
-
=
![]() .
.
Полагая, что все части газа имеют одинаковое ускорение, по второму закону механики M = з + п, где з и п - силы, действующие на газ со стороны задней и передней стенок бака, соответственно.
Проектируя выражение для (M ) на направление движения бака, получим с учетом того, что Fз = pзS и Fп = pпS:
Ма = (pз - pп)S.
Так как М =
![]() l
S , то выражение примет
вид
l
а = (pз - pп)
и соответственно
l
S , то выражение примет
вид
l
а = (pз - pп)
и соответственно
-
=
![]() .
.
Пример 2. В сосуде объемом V находилась при температуре Т вода в количестве m. В результате нагрева на Т вода испарилась. Найти давление ее паров до и после нагрева.
Решение:
Первоначальное состояние пара описывается
уравнением p1(V-
Vв) =![]() .
.
При этом пар был
насыщенным, так как находился достаточно
долго в сосуде одновременно с водой и,
значит, M = н(V-
Vв). Исключая из
уравнений массу пара М, получим
p1 =
![]() .
При этом
.
При этом
![]() берется из таблиц. Для конечного состояния
системы (после испарения воды) имеем
берется из таблиц. Для конечного состояния
системы (после испарения воды) имеем
![]() .
Подстановка приводит к уравнению
.
Подстановка приводит к уравнению
![]() ,
где
,
где
![]() ,
,
![]() и
-
табличные данные, а t
= T – 273 K
(температура воды перед нагревом). При
решении не учитывается зависимость
плотности воды от давления и изменения
объема сосуда при изменении температуры.
и
-
табличные данные, а t
= T – 273 K
(температура воды перед нагревом). При
решении не учитывается зависимость
плотности воды от давления и изменения
объема сосуда при изменении температуры.
