
- •1. Биохимия - молекулярная логика живых организмов. Состав живой материи
- •1.1. Химическая организация клетки. Основные классы биомолекул, общие принципы их строения
- •1.2. Строение и функции клетки эукариотов и прокариотов. Внутриклеточные органеллы.
- •1.3. Особенности организации биосинтетических процессов в клетках прокариот и эукариот
- •2. Аминокислоты и белки
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Кислотно-основные свойства аминокислот
- •2.2. Пептиды. Строение пептидов. Особенности пептидной связи.
- •2.3. Белки и их основные признаки. Классификации белков. Биологические функции белков и пептидов (ферменты, гормоны, транспортные белки, структурные белки, иммуноглобулины, рецепторы).
- •Классификация белков
- •Биологические функции белков
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •2.6.Четвертичная структура белка. Свойства олигомерных белков. Роль четвертичной структуры в проявлении определенных функций белка.
- •К инетика оксигенирования миоглобина и гемоглобина
- •Транспорт двуокиси углерода
- •Молекулярная основа эффекта Бора
- •Регуляция 2,3-бисфосфоглицератом
- •Изофункциональные белки
- •3.Биологический катализ. Ферменты.
- •Особенности ферментов как биокатализаторов
- •Ферменты
- •Принципы построения рабочего названия фермента
- •Список ферментов
- •Механизм действия ферментов. Активный центр ферментов
- •Механизм действия ферментов (на примере фермента холинэстеразы)
- •Причины высокой каталитической активности.
- •3.2.Субстратная специфичность. Специфичность пути превращения.
- •Специфичность пути превращения
- •6.2. Линеризация уравнения Михаэлиса-Ментен
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Регуляция белковыми ингибиторами
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •4. Строение, состав и физиологическая роль клеточной стенки и цитоплазматической мембраны.
- •Функции мембран
- •Мембранные липиды. Образование липидного бислоя мембран.
- •Мембранные белки. Жидко-мозаичное строение мембран
- •Функции мембранных гликолипидов, гликопротеинов, белков:
- •Свойства биологических мембран
- •Пассивный транспорт
- •Активный транспорт
- •Экзо- и эндоцитоз
- •Системы унипорта, симпорта и антипорта
- •4.3. Строение клеточной стенки грамположительных и грамотрицательных бактерий.
- •5. Пути и механизмы преобразования энергии в живых системах
- •5.1. Метаболизм. Катаболизм и анаболизм
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Субстратное и окислительное фосфорилирование
- •Организация дыхательной цепи в митохондриях
- •Механизм сопряжения окисления и фосфорилирования
- •Строение атф-синтазы и синтез атф
- •Коэффициент окислительного фосфорилирования
- •Дыхательный контроль
- •Энергетический обмен и теплопродукция
- •5.4. Фотосинтез и хемосинтез. Фотосинтез
- •Световая стадия фотосинтеза
- •Механизм световой фазы фотосинтеза
- •Темновая фаза фотосинтеза
- •Хемосинтез
- •6. Основные метаболические пути углеводов.
- •6.1. Общая схема превращения глюкозы. Метаболизм глюкозы в печени
- •Энергетический выход аэробного распада глюкозы
- •6.3. Пентозфосфатный путь.
- •Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.4. Брожение.
- •6.5. Биосинтез глюкозы. Обходные пути глюконеогенеза. Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.6. Биосинтез глюкозы из двухуглеродных соединений (глиоксилатный цикл).
- •7. Обмен липидов.
- •7.1. Катаболизм глицерина.
- •Окисление до со2 и образование атф
- •7.3. Биосинтез липидов.
- •8. Обмен белков
- •8.1. Общая схема метаболизма аминокислот. Механизмы транспорта аминокислот в клетку. Метаболизм аминокислот в печени
- •8.2. Дезаминирование аминокислот: окислительное дезаминирование, трансаминирование, непрямое дезаминирование (трансдезаминирование).
- •8.3. Превращения углеродного скелета аминокислот. Кетогенные и гликогенные аминокислоты.
- •8.4. Декарбоксилирование аминокислот. Биогенные амины.
- •8.5. Азотфиксация.
- •8.6. Биосинтез заменимых и незаменимых аминокислот.
- •9. Вторичные метаболиты бактерий и растений
- •Библиография
2.2. Пептиды. Строение пептидов. Особенности пептидной связи.
Первичной структурой белка называют состав и последовательность аминокислотных остатков в белковой молекуле. Аминокислоты в белке связаны пептидными связями.
П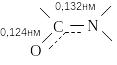 ептидная
связь имеет транс-конфигурацию, в
которой боковые радикалы аминокислотных
остатков наиболее удалены друг от друга.
ептидная
связь имеет транс-конфигурацию, в
которой боковые радикалы аминокислотных
остатков наиболее удалены друг от друга.
Один конец цепи, на котором находится аминокислота со свободной аминогруппой, называют N-концом. Другой конец, на котором находится аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды принято записывать и называть, начиная с N-конца.
Все молекулы данного индивидуального белка идентичны по аминокислотному составу, последовательности аминокислотных остатков и длине полипептидной цепи. Даже небольшие изменения первичной структуры могут значительно изменять свойства белка.
2.3. Белки и их основные признаки. Классификации белков. Биологические функции белков и пептидов (ферменты, гормоны, транспортные белки, структурные белки, иммуноглобулины, рецепторы).
Белки - очень крупные молекулы, молярная масса белков колеблется от 6ооо до 1 млн. грамм/моль.
Некоторые белки в своем составе могут иметь химические группы небелковой природы. Такие белки называют сложными или холопротеинами. Неаминокислотную часть белков называют простетической группой, белковую часть - апоферментом. Сложные белки классифицируются по простетической группе. Например, липопротеины это белки, содержащие в своем составе группу - липид; металлопротеины содержат в своем составе ионы металла; в состав хромопротеинов входит хромофор, окрашенная группа небелковой природы.
Белки можно классифицировать по форме молекул и по способности растворяться в воде на глобулярные и фибриллярные. Глобулярные белки имеют форму глобулы и, как правило, растворимы в воде. Фибриллярные белки имеют форму вытянутого волокна - фибриллы и нерастворимы в воде. Фибриллярные белки выполняют главным образом опорные функции, обеспечивая прочность тканей; глобулярные белки более разнообразны по функциям.
Классификация белков
по растворимости
Альбумины. Растворимы в воде и солевых растворах.
Глобулины. Слаборастворимы в воде, но хорошо растворимы в солевых растворах.
Проламины. Растворимы в 70-80% этаноле, нерастворимы в воде и абсолютном спирте. Богаты аргинином.
Гистоны. Растворимы в солевых растворах.
Склеропротеины. Нерастворимы в воде и солевых растворах. Повышено содержание глицина, аланина, пролина.
Биологические функции белков
Ферменты - это биологические катализаторы, самый многообразный, многочисленный класс белков. Почти все химические реакции, в которых участвуют присутствующие в клетке органические биомолекулы, катализируются ферментами. Настоящему времени открыто более 2000 различных ферментов.
Транспортные белки - Транспортные белки плазмы крови связывают и переносят специфические молекулы или ионы из одного органа в другой. Например, гемоглобин, содержащийся в эритроцитах, при прохождении через легкие связывает кислород и доставляет его к периферическим тканям, где кислород освобождается. Плазма крови содержит липопротеины, осуществляющие перенос липидов из печени в другие органы. В клеточных мембранах присутствует еще один клеточный тип транспортных белков, способных связывать определенные молекулы (напр., глюкозу) и переносить их через мембрану внутрь клетки.
Пищевые и запасные белки. Наиболее известными примерами таких белков служат белки семян пшеницы, кукурузы, риса. К пищевым белкам относится яичный альбумин - основной компонент яичного белка, казеин - главный белок молока.
Сократительные и двигательные белки. Актин и миозин - белки, функционирующие в сократительной системе скелетной мышцы, а также во многих немышечных тканях.
Структурные белки. Коллаген - главный компонент хрящей и сухожилий. Этот белок имеет очень высокую прочность на разрыв. Связки содержат эластин - структурный белок, способный растягиваться в двух измерениях. Волосы, ногти состоят почти исключительно из прочного нерастворимого белка - кератина. Главным компонентом шелковых нитей и паутины служит белок фиброин.
Защитные белки. Иммуноглобулины или антитела - это специализированные клетки, вырабатываемые в лимфоцитах. Они обладают способностью распознавать проникшие в организм бактерии вирусы или чужеродные молекулы, а затем запускать систему их нейтрализации. Фибриноген и тромбин - белки, участвующие в процессе свертывания крови, они предохраняют организм от потери крови при повреждении сосудистой системы.
Регуляторные белки. Некоторые белки и пептиды участвуют в регуляции клеточной активности. К ним относятся многие гормоны, такие как инсулин (регулирует обмен глюкозы).
Энкефалины. короткие пептиды, синтезируемые в центральной нервной системе. Они представляют собой наркотики, вырабатываемые самим организмом.
Антибиотики и токсичные ядовитые вещества. Например, аманитин - яд, содержащийся в грибах. Многие антибиотики являются пептидами.
2.4. Структурная организация белковых молекул. Первичная структура полипептидных цепей. Пептиды. Конформация белковых молекул. Вторичная структура полипептидных цепей. Третичная структура белков. Связь третичной структуры с первичной структурой. Физико-химические свойства белков. Денатурация и ренатурация белков.
 Первичной
структурой белка называют
состав и последовательность аминокислотных
остатков в белковой молекуле. Аминокислоты
в белке связаны пептидными связями.
Первичной
структурой белка называют
состав и последовательность аминокислотных
остатков в белковой молекуле. Аминокислоты
в белке связаны пептидными связями.
Все молекулы данного индивидуального белка идентичны по аминокислотному составу, последовательности аминокислотных остатков и длине полипептидной цепи. Установление последовательности аминокислотной последовательности белков - трудоемкая задача. Более подробно на эту тему мы поговорим на семинаре. Инсулин был первым белком, для которого установили аминокислотную последовательность. Бычий инсулин имеет молярную массу около 5700. Его молекула состоит из двух полипептидных цепей: А-цепи, содержащей 21 а.к., и В-цепи, содержащей 30 а.к., эти две цепи соединены двумя дисульфидными ( -S-S-) связями. Даже небольшие изменения первичной структуры могут значительно изменять свойства белка. Болезнь серповидноклеточная анемия является результатом изменения всего 1 аминокислоты в -цепи гемоглобина (Glu Val).
Видовая специфичность первичной структуры
При изучении аминокислотных последовательностей гомологичных белков, выделенных из разных видов, было сделано несколько важных выводов. К гомологичным белкам относятся те белки, которые у разных видов выполняют одинаковые функции. Примером может служить гемоглобин: у всех позвоночных он осуществляет одну и ту же функцию, связанную с транспортом кислорода. Гомологичные белки разных видов обычно имеют полипептидные цепи одинаковой или почти одинаковой длины. В аминокислотных последовательностях гомологичных белков во многих положениях всегда находятся одни и те же аминокислоты - их называют инвариантными остатками. Вместе с тем в других положениях белков наблюдаются значительные различия: в этих положениях аминокислоты варьируются от вида к виду; такие аминокислотные остатки называются вариабельными. Всю совокупность сходных черт в аминокислотных последовательностях гомологичных белков объединяют в понятие гомология последовательностей. Наличие такой гомологии предполагает, что животные, из которых были выделены гомологичные белки, имеют общее эволюционное происхождение. Интересным примером является сложный белок - цитохром с - митохондриальный белок, учавствующий в качестве переносчика электронов в процессах биологического окисления. М 12500, содержит 100 а.к. Были установлены а.к. последовательности для 60 видов. 27 а.к. - одинаковы, это указывает на то, что все эти остатки играют важную роль в определении биологической активности цитохрома с. Второй важный вывод, сделанный на основе анализа аминокислотных последовательностей, состоит в том, что число остатков, по которым различаются цитохромы с любых двух видов, пропорционально филогенетическому различию между данными видами. Например, молекулы цитохрома с лошади и дрожжей различаются по 48 а.к., у утки и курицы - по 2 а.к., у курицы и индейки не различаются. Сведения с числе различий в аминокислотных последовательностях гомологичных белков из разных видов используют для построения эволюционных карт, отражающих последовательные этапы возникновения и развития различных видов животных и растений в процессе эволюции.
