
- •1. Биохимия - молекулярная логика живых организмов. Состав живой материи
- •1.1. Химическая организация клетки. Основные классы биомолекул, общие принципы их строения
- •1.2. Строение и функции клетки эукариотов и прокариотов. Внутриклеточные органеллы.
- •1.3. Особенности организации биосинтетических процессов в клетках прокариот и эукариот
- •2. Аминокислоты и белки
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Кислотно-основные свойства аминокислот
- •2.2. Пептиды. Строение пептидов. Особенности пептидной связи.
- •2.3. Белки и их основные признаки. Классификации белков. Биологические функции белков и пептидов (ферменты, гормоны, транспортные белки, структурные белки, иммуноглобулины, рецепторы).
- •Классификация белков
- •Биологические функции белков
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •2.6.Четвертичная структура белка. Свойства олигомерных белков. Роль четвертичной структуры в проявлении определенных функций белка.
- •К инетика оксигенирования миоглобина и гемоглобина
- •Транспорт двуокиси углерода
- •Молекулярная основа эффекта Бора
- •Регуляция 2,3-бисфосфоглицератом
- •Изофункциональные белки
- •3.Биологический катализ. Ферменты.
- •Особенности ферментов как биокатализаторов
- •Ферменты
- •Принципы построения рабочего названия фермента
- •Список ферментов
- •Механизм действия ферментов. Активный центр ферментов
- •Механизм действия ферментов (на примере фермента холинэстеразы)
- •Причины высокой каталитической активности.
- •3.2.Субстратная специфичность. Специфичность пути превращения.
- •Специфичность пути превращения
- •6.2. Линеризация уравнения Михаэлиса-Ментен
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Регуляция белковыми ингибиторами
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •4. Строение, состав и физиологическая роль клеточной стенки и цитоплазматической мембраны.
- •Функции мембран
- •Мембранные липиды. Образование липидного бислоя мембран.
- •Мембранные белки. Жидко-мозаичное строение мембран
- •Функции мембранных гликолипидов, гликопротеинов, белков:
- •Свойства биологических мембран
- •Пассивный транспорт
- •Активный транспорт
- •Экзо- и эндоцитоз
- •Системы унипорта, симпорта и антипорта
- •4.3. Строение клеточной стенки грамположительных и грамотрицательных бактерий.
- •5. Пути и механизмы преобразования энергии в живых системах
- •5.1. Метаболизм. Катаболизм и анаболизм
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Субстратное и окислительное фосфорилирование
- •Организация дыхательной цепи в митохондриях
- •Механизм сопряжения окисления и фосфорилирования
- •Строение атф-синтазы и синтез атф
- •Коэффициент окислительного фосфорилирования
- •Дыхательный контроль
- •Энергетический обмен и теплопродукция
- •5.4. Фотосинтез и хемосинтез. Фотосинтез
- •Световая стадия фотосинтеза
- •Механизм световой фазы фотосинтеза
- •Темновая фаза фотосинтеза
- •Хемосинтез
- •6. Основные метаболические пути углеводов.
- •6.1. Общая схема превращения глюкозы. Метаболизм глюкозы в печени
- •Энергетический выход аэробного распада глюкозы
- •6.3. Пентозфосфатный путь.
- •Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.4. Брожение.
- •6.5. Биосинтез глюкозы. Обходные пути глюконеогенеза. Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.6. Биосинтез глюкозы из двухуглеродных соединений (глиоксилатный цикл).
- •7. Обмен липидов.
- •7.1. Катаболизм глицерина.
- •Окисление до со2 и образование атф
- •7.3. Биосинтез липидов.
- •8. Обмен белков
- •8.1. Общая схема метаболизма аминокислот. Механизмы транспорта аминокислот в клетку. Метаболизм аминокислот в печени
- •8.2. Дезаминирование аминокислот: окислительное дезаминирование, трансаминирование, непрямое дезаминирование (трансдезаминирование).
- •8.3. Превращения углеродного скелета аминокислот. Кетогенные и гликогенные аминокислоты.
- •8.4. Декарбоксилирование аминокислот. Биогенные амины.
- •8.5. Азотфиксация.
- •8.6. Биосинтез заменимых и незаменимых аминокислот.
- •9. Вторичные метаболиты бактерий и растений
- •Библиография
Причины высокой каталитической активности.
Фермент поддерживает микроокружение субстрата в активном центре в состоянии отличном от его состояния в водной среде.
Располагает реагирующие атомы в правильной ориентации и на необходимом расстоянии друг от друга, чтобы обеспечить оптимальное протекание реакции.
За счет кооперативного взаимодействия субстрата и нескольких остатков аминокислот в активном центре фермент снижает энергию активации данной реакции.
3.2.Субстратная специфичность. Специфичность пути превращения.
Структура активного центра фермента комплементарна структуре субстрата, т.е. соответствует ему по 1) форме, 2) размерам и 3) способности взаимодействовать. Это является причинами высокой специфичности ферментов.
Первоначально модель активного центра, предложенная Э.Фишером, трактовала взаимодействие субстрата и фермента по аналогии с системой «ключ-замок» – модель «жесткой матрицы». Однако эта модель объясняла лишь абсолютную субстратную специфичность. Фермент с абсолютной специфичностью катализирует превращение какого-либо одного субстрата. Например, фумараза катализирует только реакцию фумаровой кислоты с водой:

Кошланд предложил модель индуцированного соответствия. Главная черта этой модели – гибкость каталитического центра. В модели Фишера каталитический центр считается заранее подготовленным под форму молекулы-субстрата. В модели Кошланда субстрат индуцирует конформационные изменения фермента, и лишь в результате этих аминокислотные остатки и другие группы фермента принимают пространственную ориентацию, необходимую для связи с субстратом и катализа. Эта модель позволяет объяснить относительную специфичность фермента.
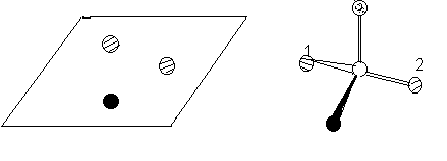
Активный центр фермента имеет трехмерную структуру, поэтому ферменты проявляют в большинстве случаев абсолютную оптическую специфичность за исключением эпимераз (рацемаз), которые катализируют взаимопревращение оптических изомеров.
Кроме того, большинство субстратов образуют, как правило, не меньше трех связей с ферментом. Благодаря такой «трехточечной фиксации» симметричная молекула может проявлять асимметрию.
Х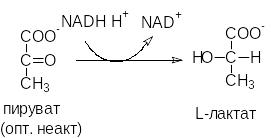 имические
изменения могут происходить только с
группой 1, но не 2.
имические
изменения могут происходить только с
группой 1, но не 2.
Специфичность пути превращения
Каждый фермент катализирует не любые из всех возможных путей превращения субстрата, а какое-либо одно. Это свойство называется специфичностью пути превращения. Например, у ферментов гистидазы и гистидиндекарбоксилазы один субстрат – гистидин, но катализируют эти ферменты разные превращения гистидина
3.3.Кинетика ферментативных реакций. Зависимость скорости реакции от концентрации субстрата, фермента, от температуры, рН среды. Ингибиторы ферментов (обратимые и необратимые, конкурентные и неконкурентные).
Зависимость скорости ферментативной реакции от концентрации субстрата. Уравнение Михаэлиса-Ментен.
Любую ферментативную реакцию схематично можно описать следующим образом:
![]()
Поведение многих ферментов при изменении концентрации субстрата описывает уравнение Михаэлиса-Ментен:
![]() ,
где
,
где
![]() -
скорость ферментативной реакции,
-
скорость ферментативной реакции,
![]() -
максимальная скорость ферментативной
реакции при полном насыщении фермента
субстратом,
-
максимальная скорость ферментативной
реакции при полном насыщении фермента
субстратом,
![]() – константа
Михаэлиса,
– константа
Михаэлиса,
![]() –
концентрация
субстрата.
–
концентрация
субстрата.
![]() -
константа образования фермент-субстратного
комплекса ES,
-
константа образования фермент-субстратного
комплекса ES,
![]() -
константа диссоциации фермент-субстратного
комплекса ES.
-
константа диссоциации фермент-субстратного
комплекса ES.
Влияние концентрации субстрата на скорость ферментативной реакции, описываемое этим уравнением, можно изобразить графически:
![]()
 равна
концентрации субстрата при скорости
ферментативной реакции, равной половине
максимальной скорости и характеризует
сродство данного фермента к тому или
иному субстрату.
равна
концентрации субстрата при скорости
ферментативной реакции, равной половине
максимальной скорости и характеризует
сродство данного фермента к тому или
иному субстрату.
Некоторые ферменты
требуют высокой концентрации субстрата
для достижения скорости, равной
максимальной, другие (например,
гексокиназа) достигают
![]() при очень низкой концентрации субстрата.
при очень низкой концентрации субстрата.
Таблица. Значения констант Михаэлиса для некоторых ферментов.
Фермент |
Субстрат |
|
каталаза |
H2O2 |
25 |
гексокиназа (мозг) |
D-глюкоза |
0,05 |
|
D-фруктоза |
1,5 |
|
АТФ |
0,4 |
карбоангидраза |
HCO3- |
9 |
химотрипсин |
Gly-Tyr-Gly |
108 |
|
N-бензоилтирозинамид |
2,5 |
![]() - скорость реакции
при 250С, оптимальном значении рН,
полном насыщении фермента субстратом.
- скорость реакции
при 250С, оптимальном значении рН,
полном насыщении фермента субстратом.
![]() -
число оборотов фермента, т.е. число
молекул субстрата, которое превращает
одна молекула фермента за 1 минуту.
-
число оборотов фермента, т.е. число
молекул субстрата, которое превращает
одна молекула фермента за 1 минуту.
Например:
карбоксиангидраза 36000000
-амилаза 1100000
фосфоглюкомутаза 1240
