
- •1. Биохимия - молекулярная логика живых организмов. Состав живой материи
- •1.1. Химическая организация клетки. Основные классы биомолекул, общие принципы их строения
- •1.2. Строение и функции клетки эукариотов и прокариотов. Внутриклеточные органеллы.
- •1.3. Особенности организации биосинтетических процессов в клетках прокариот и эукариот
- •2. Аминокислоты и белки
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Кислотно-основные свойства аминокислот
- •2.2. Пептиды. Строение пептидов. Особенности пептидной связи.
- •2.3. Белки и их основные признаки. Классификации белков. Биологические функции белков и пептидов (ферменты, гормоны, транспортные белки, структурные белки, иммуноглобулины, рецепторы).
- •Классификация белков
- •Биологические функции белков
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •2.6.Четвертичная структура белка. Свойства олигомерных белков. Роль четвертичной структуры в проявлении определенных функций белка.
- •К инетика оксигенирования миоглобина и гемоглобина
- •Транспорт двуокиси углерода
- •Молекулярная основа эффекта Бора
- •Регуляция 2,3-бисфосфоглицератом
- •Изофункциональные белки
- •3.Биологический катализ. Ферменты.
- •Особенности ферментов как биокатализаторов
- •Ферменты
- •Принципы построения рабочего названия фермента
- •Список ферментов
- •Механизм действия ферментов. Активный центр ферментов
- •Механизм действия ферментов (на примере фермента холинэстеразы)
- •Причины высокой каталитической активности.
- •3.2.Субстратная специфичность. Специфичность пути превращения.
- •Специфичность пути превращения
- •6.2. Линеризация уравнения Михаэлиса-Ментен
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Регуляция белковыми ингибиторами
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •4. Строение, состав и физиологическая роль клеточной стенки и цитоплазматической мембраны.
- •Функции мембран
- •Мембранные липиды. Образование липидного бислоя мембран.
- •Мембранные белки. Жидко-мозаичное строение мембран
- •Функции мембранных гликолипидов, гликопротеинов, белков:
- •Свойства биологических мембран
- •Пассивный транспорт
- •Активный транспорт
- •Экзо- и эндоцитоз
- •Системы унипорта, симпорта и антипорта
- •4.3. Строение клеточной стенки грамположительных и грамотрицательных бактерий.
- •5. Пути и механизмы преобразования энергии в живых системах
- •5.1. Метаболизм. Катаболизм и анаболизм
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Субстратное и окислительное фосфорилирование
- •Организация дыхательной цепи в митохондриях
- •Механизм сопряжения окисления и фосфорилирования
- •Строение атф-синтазы и синтез атф
- •Коэффициент окислительного фосфорилирования
- •Дыхательный контроль
- •Энергетический обмен и теплопродукция
- •5.4. Фотосинтез и хемосинтез. Фотосинтез
- •Световая стадия фотосинтеза
- •Механизм световой фазы фотосинтеза
- •Темновая фаза фотосинтеза
- •Хемосинтез
- •6. Основные метаболические пути углеводов.
- •6.1. Общая схема превращения глюкозы. Метаболизм глюкозы в печени
- •Энергетический выход аэробного распада глюкозы
- •6.3. Пентозфосфатный путь.
- •Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.4. Брожение.
- •6.5. Биосинтез глюкозы. Обходные пути глюконеогенеза. Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.6. Биосинтез глюкозы из двухуглеродных соединений (глиоксилатный цикл).
- •7. Обмен липидов.
- •7.1. Катаболизм глицерина.
- •Окисление до со2 и образование атф
- •7.3. Биосинтез липидов.
- •8. Обмен белков
- •8.1. Общая схема метаболизма аминокислот. Механизмы транспорта аминокислот в клетку. Метаболизм аминокислот в печени
- •8.2. Дезаминирование аминокислот: окислительное дезаминирование, трансаминирование, непрямое дезаминирование (трансдезаминирование).
- •8.3. Превращения углеродного скелета аминокислот. Кетогенные и гликогенные аминокислоты.
- •8.4. Декарбоксилирование аминокислот. Биогенные амины.
- •8.5. Азотфиксация.
- •8.6. Биосинтез заменимых и незаменимых аминокислот.
- •9. Вторичные метаболиты бактерий и растений
- •Библиография
Стереоизомерия.
Все стандартные аминокислоты содержат
ассиметрический атом углерода в
-положении, т.е. атом
углерода с четырьмя различными
заместителями. Такой атом углерода
является хиральным центром. Благодаря
тому, что связи вокруг -атома
углерода имеют тераэдрическое
расположение, четыре различных заместителя
могут располагаться в пространстве
двумя различными способами, так что
молекула может существовать в двух
к онфигурациях,
представляющих собой несовместимые
зеркальные отображения.
онфигурациях,
представляющих собой несовместимые
зеркальные отображения.
Таким образом, соединения с хиральным центром встречаются в двух изомерных формах, у которых одинаковые физические и химические свойства, за исключением одного - способности вращать плоскость плоскополяризованного луча света в разные стороны на определенный угол. Эти соединения обладают оптической активностью. В основе строгой системы классификации и обозначения стереоизомеров лежит не вращение плоскости поляризации света, а абсолютная конфигурация молекулы стереоизомера, т.е. взаимное расположение четырех заместителей. Для выяснения конфигурации оптически активных соединений их сравнивают с каким-нибудь одним соединением, выбранным в качестве эталона, например, глицеральдегидом.

Почти все природные биологически активные соединения, содержащие хиральный центр, встречаются только в какой-нибудь одной стереоизомерной форме - D или L. Все аминокислоты, входящие в состав белков, являются L-изомерами. Живые клетки обладают уникальной способностью синтезировать L-аминокислоты с помощью стереоспецифичных ферментов. Стереоспецифичность этих ферментов обусловлена ассимитрическим характером их активных центров.

Кислотно-основные свойства аминокислот
Изоэл точка это значение рН, при которой концентрация биполярного иона в растворе максимальна, а концентрация аниона – минимальна (т.е. молекула заряжена нейтрально).
При растворении в воде кислоты ионизируются и ведут себя как кислоты и основания. Знание кислотно-основных свойств аминокислот имеет исключительно важное значение для понимания многих свойств белков.
По кислотно-основным свойствам аминокислоты разделяют на три группы.
Н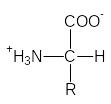 ейтральные
аминокислоты не содержат в радикале
R дополнительных кислотных
или основных центров, способных к
ионизации в водной среде. В кислой среде
они существуют в виде однозарядного
катиона и являются двухосновными
кислотами по Бренстеду. Как видно на
примере аланина, изоэлектрическая точка
у нейтральных аминокислот не равна 7, а
лежит в интервале 5,5 – 6,3.
ейтральные
аминокислоты не содержат в радикале
R дополнительных кислотных
или основных центров, способных к
ионизации в водной среде. В кислой среде
они существуют в виде однозарядного
катиона и являются двухосновными
кислотами по Бренстеду. Как видно на
примере аланина, изоэлектрическая точка
у нейтральных аминокислот не равна 7, а
лежит в интервале 5,5 – 6,3.
-Аминокислоты, содержащие одну аминогруппу и одну карбоксильную группу, кристаллизуются из нейтральных водных растворов в виде биполярных ионов (цвиттерионов).
Аминокислоты могут вести себя как кислоты (доноры протонов)
и как основания (акцепторы протонов):
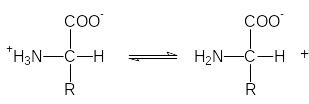
Д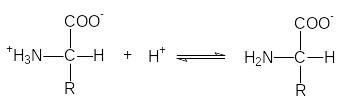 анные
равновесия можно количественно описать
константами диссоциации К1
и К2 или их отрицательными
десятичными логарифмами:
анные
равновесия можно количественно описать
константами диссоциации К1
и К2 или их отрицательными
десятичными логарифмами:
![]()
В зависимости от рН в растворе могут наблюдаться следующие равновесия:
p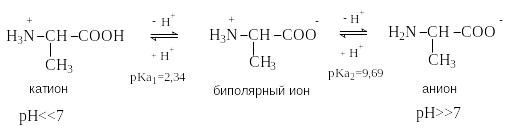 I=1/2(2,34+9,69)=6,01
I=1/2(2,34+9,69)=6,01
Основные аминокислоты содержат в радикале R дополнительный основный центр. К ним относятся лизин, гистидин и аргинин. В кислой среде они существуют в виде дикатиона и являются трехосновными кислотами. Изоэлектрическая точка основных аминокислот, как видно на примере лизина, лежит в области рН выше 7.
pI= ½(9,0+10,05)=9,74

Кислые аминокислоты содержат в радикале R дополнительный кислотный центр. К ним относятся аспаргиновая и глутаминовая кислоты. В кислой среде они существуют в виде катиона и являются трехосновными кислотами. Изоэлектрическая точка этих аминокислот лежит в области рН много ниже 7.
p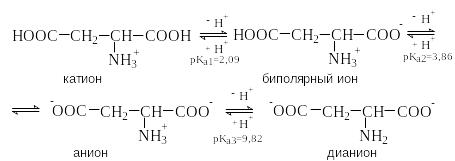 I=
½(2,09+3,86)=2,77
I=
½(2,09+3,86)=2,77
Тирозин и цистеин содержат в боковых радикалах слабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при физиологическом значении рН (~7) ни одна аминокислота не находится в изоэлектрической точке. В организме все аминокислоты ионизированы, что обеспечивает им хорошую растворимость в воде.
Частота, с какой аминокислоты встречаются в белках, неодинакова. Например, глицин обнаруживается в 10 раз чаще, чем триптофан. По частоте нахождения аминокислот в белках можно составить такой ряд: ала вал лей сер глу глн лиз арг про > асп асн изо тре фен > тир цис мет гис.
Большинство белков по аминокислотному составу отличаются не очень резко. Но некоторые белки с особыми свойствами отличаются и аминокислотным составом. Так, белок соединительной ткани коллаген на 1/3 построен из остатков глицина, около 1/5 на ост. пролина и оксипролина. Именно такой состав аминокислот позволяет готовой молекуле белка образовывать прочные олигомерные структуры - фибриллы. Фибриллы коллагена превосходят по прочности стальную проволоку равного поперечного сечения. При кипячении в воде нерастворимый коллаген превращается в желатину - растворимую смесь полипептидов. Необычный аминокислотный состав коллагена определяет его низкую питательную ценность. В состав связок и соединительной ткани стенок сосуда входит белок - эластин. Эластин богат остатками лизина. Четыре боковые группы лизина сближаются друг с другом и ферментативным путем превращаются в десмозин. Таким путем полипептидные цепи эластина могут объединяться в системы, способные обратимо растягиваться во всех направлениях.
В хромосомах содержатся положительно заряженные белки гистоны, примерно на 1/3 построенные из остатков лизина и аргинина. Положительный заряд молекулы белка позволяет образовывать прочные комплексы с отрицательно заряженными молекулами нуклеиновых кислот.
