
- •1. Биохимия - молекулярная логика живых организмов. Состав живой материи
- •1.1. Химическая организация клетки. Основные классы биомолекул, общие принципы их строения
- •1.2. Строение и функции клетки эукариотов и прокариотов. Внутриклеточные органеллы.
- •1.3. Особенности организации биосинтетических процессов в клетках прокариот и эукариот
- •2. Аминокислоты и белки
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Кислотно-основные свойства аминокислот
- •2.2. Пептиды. Строение пептидов. Особенности пептидной связи.
- •2.3. Белки и их основные признаки. Классификации белков. Биологические функции белков и пептидов (ферменты, гормоны, транспортные белки, структурные белки, иммуноглобулины, рецепторы).
- •Классификация белков
- •Биологические функции белков
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •2.6.Четвертичная структура белка. Свойства олигомерных белков. Роль четвертичной структуры в проявлении определенных функций белка.
- •К инетика оксигенирования миоглобина и гемоглобина
- •Транспорт двуокиси углерода
- •Молекулярная основа эффекта Бора
- •Регуляция 2,3-бисфосфоглицератом
- •Изофункциональные белки
- •3.Биологический катализ. Ферменты.
- •Особенности ферментов как биокатализаторов
- •Ферменты
- •Принципы построения рабочего названия фермента
- •Список ферментов
- •Механизм действия ферментов. Активный центр ферментов
- •Механизм действия ферментов (на примере фермента холинэстеразы)
- •Причины высокой каталитической активности.
- •3.2.Субстратная специфичность. Специфичность пути превращения.
- •Специфичность пути превращения
- •6.2. Линеризация уравнения Михаэлиса-Ментен
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Регуляция белковыми ингибиторами
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •4. Строение, состав и физиологическая роль клеточной стенки и цитоплазматической мембраны.
- •Функции мембран
- •Мембранные липиды. Образование липидного бислоя мембран.
- •Мембранные белки. Жидко-мозаичное строение мембран
- •Функции мембранных гликолипидов, гликопротеинов, белков:
- •Свойства биологических мембран
- •Пассивный транспорт
- •Активный транспорт
- •Экзо- и эндоцитоз
- •Системы унипорта, симпорта и антипорта
- •4.3. Строение клеточной стенки грамположительных и грамотрицательных бактерий.
- •5. Пути и механизмы преобразования энергии в живых системах
- •5.1. Метаболизм. Катаболизм и анаболизм
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Субстратное и окислительное фосфорилирование
- •Организация дыхательной цепи в митохондриях
- •Механизм сопряжения окисления и фосфорилирования
- •Строение атф-синтазы и синтез атф
- •Коэффициент окислительного фосфорилирования
- •Дыхательный контроль
- •Энергетический обмен и теплопродукция
- •5.4. Фотосинтез и хемосинтез. Фотосинтез
- •Световая стадия фотосинтеза
- •Механизм световой фазы фотосинтеза
- •Темновая фаза фотосинтеза
- •Хемосинтез
- •6. Основные метаболические пути углеводов.
- •6.1. Общая схема превращения глюкозы. Метаболизм глюкозы в печени
- •Энергетический выход аэробного распада глюкозы
- •6.3. Пентозфосфатный путь.
- •Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.4. Брожение.
- •6.5. Биосинтез глюкозы. Обходные пути глюконеогенеза. Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.6. Биосинтез глюкозы из двухуглеродных соединений (глиоксилатный цикл).
- •7. Обмен липидов.
- •7.1. Катаболизм глицерина.
- •Окисление до со2 и образование атф
- •7.3. Биосинтез липидов.
- •8. Обмен белков
- •8.1. Общая схема метаболизма аминокислот. Механизмы транспорта аминокислот в клетку. Метаболизм аминокислот в печени
- •8.2. Дезаминирование аминокислот: окислительное дезаминирование, трансаминирование, непрямое дезаминирование (трансдезаминирование).
- •8.3. Превращения углеродного скелета аминокислот. Кетогенные и гликогенные аминокислоты.
- •8.4. Декарбоксилирование аминокислот. Биогенные амины.
- •8.5. Азотфиксация.
- •8.6. Биосинтез заменимых и незаменимых аминокислот.
- •9. Вторичные метаболиты бактерий и растений
- •Библиография
Роль высокоэнергетических фосфатов в улавливании энергии. Субстратное и окислительное фосфорилирование
Главный путь синтеза АТФ из АДФ - окислительное фосфорилирование. При этом АДФ фосфорилируется неорганическим фосфатом:
АДФ + H3PO4 + энергия АТФ + H2O
Реакция энергетически сопряжена с переносом водорода с восстановительных эквивалентов на кислород. Восстановительные эквиваленты образуются при окислении органических молекул. Последовательность реакций, с помощью которых организм использует энергию связей органических молекул для синтеза АТФ, и при этом углерод органических молекул превращается в углекислый газ, а водород (Н+ и е-) переносится на молекулярный кислород с образованием молекулы воды, называется клеточным дыханием.
Другой путь синтеза АТФ из АДФ - субстратное фосфорилирование. В этом случае макроэргическая связь в молекуле АТФ может образоваться за счет энергии макроэргической связи в другом субстрате (например, креатинфосфате).
Таким образом, энергия пищевых веществ в клетке трансформируется сначала в энергию АТФ, а затем АТФ служит непосредственным источником энергии для совершения работы в биохимических и физиологических процессах.
5.3. Организация дыхательной цепи в митохондриях. Механизм сопряжения окисления и фосфорилирования. Строение АТФ-синтазы и синтез АТФ. Коэффициент окислительного фосфорилирования. Дыхательный контроль. Энергетический обмен и теплопродукция
Большая часть энергии, высвобождаемой при окислении жирных кислот, аминокислот и углеводов запасается в виде восстановительных эквивалентов никотинамидадениндинуклеотида (НАДНН+) и флавинадениндинуклеотида (ФАДН2), которые поставляются в дыхательную цепь для преобразования энергии химических связей в энергию электрохимического потенциала при прохождении восстановительных эквивалентов (Н+ и е-) по цепи переноса электронов. Энергия электрохимического потенциала затем вновь преобразуется в химическую энергию макроэргических связей АТФ в процессе окислительного фосфорилирования.
Организация дыхательной цепи в митохондриях
В состав внутренней мембраны митохондрий входит кардиолипин (менее полярный липид, чем другие мембранные липиды), поэтому мембрана проницаема только для малых незаряженных молекул, непроницаема для заряженных молекул (особенно для ионов Н+) и содержит специальные переносчики для неорганического фосфата, АДФ, АТФ, аминокислот, жирных кислот, ди- и трикарбоновых кислот и их производных.
Компоненты цепи переноса электронов и ферменты окислительного фосфорилирования АДФ также локализованы во внутренней мембране митохондрий ( 20-25 % всех белков внутренней мембраны митохондрий).
Компоненты дыхательной цепи в основном являются сложными интегральными белками, коферменты которых могут участвовать в обратимых окислительно-восстановительных реакциях. Они располагаются последовательно в порядке возрастания восстановительных потенциалов. Атомы водорода или электроны перемещаются по цепи от более электроотрицательных компонентов к более электроположительному кислороду. Главная дыхательная цепь в митохондриях начинается от НАД-зависимых дегидрогеназ, проходит через флавопротеины и цитохромы и заканчивается молекулярным кислородом. Не все субстраты связаны с цепью переноса электронов через НАД-зависимые дегидрогеназы, некоторые связаны с флавопротеиновыми дегидрогеназами, которые в свою очередь связаны с цитохромами дыхательной цепи.
Белки, участвующие в транспорте электронов ассоциированы в комплексы I, II, III и IV.
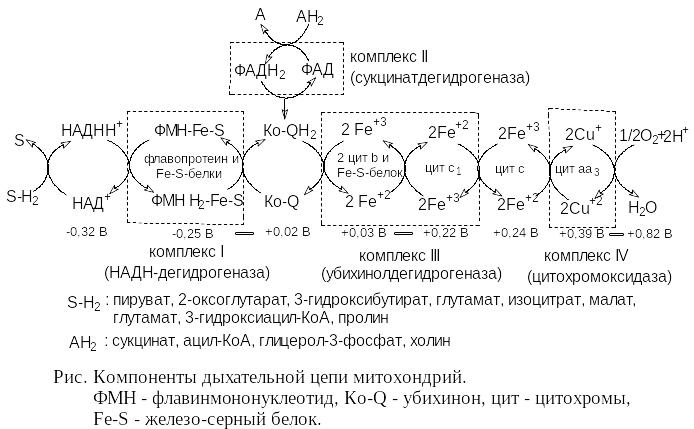
Рис. Компоненты дыхательной цепи митохондрий. ФМН – флавинмононуклеотид, КоQ – убихинон, цит – цитохромы, Fe-S – железосерный белок.
Комплекс I (НАДН:КоQ-оксидоредуктаза) представляет собой НАДН-дегидрогеназу с кофактором ФМН и негемовые белки, в состав которых входят железо-серные центры. Комплекс I способен катализировать перенос атомов водорода (Н+ и е-) от НАДН на убихинон. Е0` 0,35 В для этого переноса, соответственно G0` 67 кДж/моль. Этого вполне достаточно для синтеза АТФ.
Комплекс II (сукцинат:КоQ-оксидоредуктаза с коферментом ФАД) известен как сукцинатдегидрогеназа. Е0` 0,05 В для этого переноса, соответственно G0` 9.6 кДж/моль. Этого недостаточно для синтеза АТФ.
Кофермент Q - (убихинон) малый мобильный переносчик атомов водорода. КоQ гидрофобен в окисленном и восстановленном состоянии и легко диффундирует в липидном слое мембраны, передавая только электроны комплексу III.
В комплекс III (убихинолдегидрогеназу) входят цитохромы b, цитохром с1 и железо-серный белок Риске. При переносе электронов через комплекс III наблюдается второй скачок потенциала.
Электронным переносчиком от комплекса III на комплекс IV является самый маленький цитохром - цитохром с.
Комплекс IV (цитохромоксидаза) содержит цитохромы а, а3 и медь-связывающие белки, в которых ион меди меняет степень окисления (Cu+ Cu2+), передавая электроны на молекулярный кислород О2. На этом этапе - третий скачок потенциала. Цитохромоксидаза имеет очень высокое сродство к О2 и функционирует с максимальной скоростью пока есть хоть небольшое количество кислорода в ткани. Эта реакция необратима и определяет направление переноса электронов на кислород. О2 - конечный акцептор электронов, превращается в Н2О - конечный продукт восстановления.

Нормальное окисление НАДН и сукцината всегда двух электронная реакция с переносом двух атомов водорода (Н+ и е-) на флавин. В отличие от НАДН и сукцината флавины и КоQ могут участвовать в одно- и двух электронных реакциях, приводящих к образованию восстановленного хинола, окисленного хинона и промежуточной формы - семихинона.
Способность флавинов и КоQ образовывать семихиноновые промежуточные соединения является ключевым моментом в электронном транспорте в митохондриях, т.к. эти кофакторы связывают обязательные двух электронные реакции НАДН и сукцината с обязательными одноэлектронными реакциями в цитохромах.
Цитохромы - это сложные белки, содержащие в качестве простетической группы гем. В отличие от гемоглобина и миоглобина гемовое железо цитохромов обратимо меняет степень окисления (Fe2+ Fe3+).
