
- •1. Биохимия - молекулярная логика живых организмов. Состав живой материи
- •1.1. Химическая организация клетки. Основные классы биомолекул, общие принципы их строения
- •1.2. Строение и функции клетки эукариотов и прокариотов. Внутриклеточные органеллы.
- •1.3. Особенности организации биосинтетических процессов в клетках прокариот и эукариот
- •2. Аминокислоты и белки
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Кислотно-основные свойства аминокислот
- •2.2. Пептиды. Строение пептидов. Особенности пептидной связи.
- •2.3. Белки и их основные признаки. Классификации белков. Биологические функции белков и пептидов (ферменты, гормоны, транспортные белки, структурные белки, иммуноглобулины, рецепторы).
- •Классификация белков
- •Биологические функции белков
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •2.6.Четвертичная структура белка. Свойства олигомерных белков. Роль четвертичной структуры в проявлении определенных функций белка.
- •К инетика оксигенирования миоглобина и гемоглобина
- •Транспорт двуокиси углерода
- •Молекулярная основа эффекта Бора
- •Регуляция 2,3-бисфосфоглицератом
- •Изофункциональные белки
- •3.Биологический катализ. Ферменты.
- •Особенности ферментов как биокатализаторов
- •Ферменты
- •Принципы построения рабочего названия фермента
- •Список ферментов
- •Механизм действия ферментов. Активный центр ферментов
- •Механизм действия ферментов (на примере фермента холинэстеразы)
- •Причины высокой каталитической активности.
- •3.2.Субстратная специфичность. Специфичность пути превращения.
- •Специфичность пути превращения
- •6.2. Линеризация уравнения Михаэлиса-Ментен
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Регуляция белковыми ингибиторами
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •4. Строение, состав и физиологическая роль клеточной стенки и цитоплазматической мембраны.
- •Функции мембран
- •Мембранные липиды. Образование липидного бислоя мембран.
- •Мембранные белки. Жидко-мозаичное строение мембран
- •Функции мембранных гликолипидов, гликопротеинов, белков:
- •Свойства биологических мембран
- •Пассивный транспорт
- •Активный транспорт
- •Экзо- и эндоцитоз
- •Системы унипорта, симпорта и антипорта
- •4.3. Строение клеточной стенки грамположительных и грамотрицательных бактерий.
- •5. Пути и механизмы преобразования энергии в живых системах
- •5.1. Метаболизм. Катаболизм и анаболизм
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Субстратное и окислительное фосфорилирование
- •Организация дыхательной цепи в митохондриях
- •Механизм сопряжения окисления и фосфорилирования
- •Строение атф-синтазы и синтез атф
- •Коэффициент окислительного фосфорилирования
- •Дыхательный контроль
- •Энергетический обмен и теплопродукция
- •5.4. Фотосинтез и хемосинтез. Фотосинтез
- •Световая стадия фотосинтеза
- •Механизм световой фазы фотосинтеза
- •Темновая фаза фотосинтеза
- •Хемосинтез
- •6. Основные метаболические пути углеводов.
- •6.1. Общая схема превращения глюкозы. Метаболизм глюкозы в печени
- •Энергетический выход аэробного распада глюкозы
- •6.3. Пентозфосфатный путь.
- •Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.4. Брожение.
- •6.5. Биосинтез глюкозы. Обходные пути глюконеогенеза. Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.6. Биосинтез глюкозы из двухуглеродных соединений (глиоксилатный цикл).
- •7. Обмен липидов.
- •7.1. Катаболизм глицерина.
- •Окисление до со2 и образование атф
- •7.3. Биосинтез липидов.
- •8. Обмен белков
- •8.1. Общая схема метаболизма аминокислот. Механизмы транспорта аминокислот в клетку. Метаболизм аминокислот в печени
- •8.2. Дезаминирование аминокислот: окислительное дезаминирование, трансаминирование, непрямое дезаминирование (трансдезаминирование).
- •8.3. Превращения углеродного скелета аминокислот. Кетогенные и гликогенные аминокислоты.
- •8.4. Декарбоксилирование аминокислот. Биогенные амины.
- •8.5. Азотфиксация.
- •8.6. Биосинтез заменимых и незаменимых аминокислот.
- •9. Вторичные метаболиты бактерий и растений
- •Библиография
6.2. Линеризация уравнения Михаэлиса-Ментен
Уравнение Михаэлиса-Ментен можно преобразить алгебраическим способом в другие формы, более удобные для анализа экспериментальных данных:

![]()
Зависимость скорости ферментативной реакции от температуры
В пределах физиологических условий зависимость скорости реакции от температуры подчиняется законам химической кинетики, т.е. описывается уравнением Аррениуса. Так при увеличении температуры тела с 360С до 390С скорость биохимических процессов в организме увеличивается в 1,2 – 1,4 раза.
В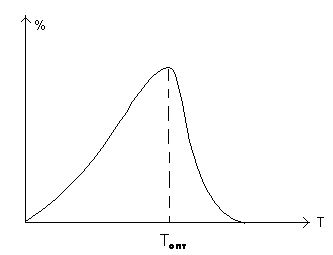 ыше
определенной температуры начинается
тепловая денатурация белковых молекул,
в том числе и ферментов, которые при
этом теряют свою биологическую активность.
ыше
определенной температуры начинается
тепловая денатурация белковых молекул,
в том числе и ферментов, которые при
этом теряют свою биологическую активность.
Зависимость скорости ферментативной реакции от рН
Большинство ферментов характерным образом изменяют свою активность в зависимости от рН. Оптимальной активности соответствует определенная область рН, причем уменьшение и увеличение рН приводит к снижению активности. Для различных реакций значения оптимума рН колеблются в широких пределах от сильно кислой среды (например, для пепсина) до сильно щелочной (например, для щелочной фосфотазы). Поэтому для работы с ферментами необходимо поддерживать рН с помощью соответствующего буфера.
Зависимость ферментативной активности от рН определяется значением рК ионогенных групп белковой молекулы, особенно тех, которые находятся в активном центре молекулы или вблизи него (и, возможно, играют роль в связывании кофермента), а также групп, ответственных за изменение состояния активного центра путем конформационных изменений белковой молекулы. Кроме того, рН может влиять на степень ионизации или пространственную организацию субстрата.
Активаторы - это молекулы или ионы, которые увеличивают активность ферментов. Часто в качестве активаторов выступают ионы металлов (Mn2+, Mg2+, Zn2+, Co2+, K+) и хлорид-ион (Cl-). Механизм активации ферментов под действием этих ионов может быть разным:
ионы являются коферментами и входят в состав активного центра;
облегчают образование ES;
облегчают присоединение кофермента к апоферменту;
обеспечивают образование устойчивой четвертичной структуры белков.
Ингибиторы - это молекулы или ионы, снижающие активность ферментов.
Различают два больших класса ингибиторов ферментативной активности - на основании того, ослабляется (конкурентное ингибирование) или не ослабляется (неконкурентное ингибирование) их ингибирующее действие при повышении концентрации субстрата.
Другой способ классификации ингибиторов основывается на характере места их связывания с ферментом в том же месте, что и субстрат (в активном центре), а другие - на значительном расстоянии от активного центра.
Обратимое конкурентное ингибирование аналогами субстрата
Химическая структура ингибитора (I) сходна со структурой субстрата, поэтому связывание ингибитора с ферментом происходит в активном центре фермента с образованием комплекса E-I. Этот комплекс может диссоциировать. Когда в реакционной смеси одновременно присутствуют и субстрат, и ингибитор, то они конкурируют за один и тот же связывающий центр. При увеличении концентрации субстрата происходит вытеснение ингибитора из активного центра фермента. Таким образом, максимальная скорость ферментативной реакции в этом случае не меняется, а константа Михаэлиса (Км) уменьшается.
Примером такого ингибирования может быть ингибирование сукцинатдегидрогеназы малонатом.
М алонат
(HOOC-(CH2)2-COOH)
способен связываться с дегидрогеназой,
образуя комплекс E-I,
но отщепление атомов водорода от малоната
не происходит.
алонат
(HOOC-(CH2)2-COOH)
способен связываться с дегидрогеназой,
образуя комплекс E-I,
но отщепление атомов водорода от малоната
не происходит.
Многие лекарственные препараты, широко применяемые в клинике, действуют как конкурентные ингибиторы очень важных ферментов.
