
- •1. Биохимия - молекулярная логика живых организмов. Состав живой материи
- •1.1. Химическая организация клетки. Основные классы биомолекул, общие принципы их строения
- •1.2. Строение и функции клетки эукариотов и прокариотов. Внутриклеточные органеллы.
- •1.3. Особенности организации биосинтетических процессов в клетках прокариот и эукариот
- •2. Аминокислоты и белки
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Кислотно-основные свойства аминокислот
- •2.2. Пептиды. Строение пептидов. Особенности пептидной связи.
- •2.3. Белки и их основные признаки. Классификации белков. Биологические функции белков и пептидов (ферменты, гормоны, транспортные белки, структурные белки, иммуноглобулины, рецепторы).
- •Классификация белков
- •Биологические функции белков
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •2.6.Четвертичная структура белка. Свойства олигомерных белков. Роль четвертичной структуры в проявлении определенных функций белка.
- •К инетика оксигенирования миоглобина и гемоглобина
- •Транспорт двуокиси углерода
- •Молекулярная основа эффекта Бора
- •Регуляция 2,3-бисфосфоглицератом
- •Изофункциональные белки
- •3.Биологический катализ. Ферменты.
- •Особенности ферментов как биокатализаторов
- •Ферменты
- •Принципы построения рабочего названия фермента
- •Список ферментов
- •Механизм действия ферментов. Активный центр ферментов
- •Механизм действия ферментов (на примере фермента холинэстеразы)
- •Причины высокой каталитической активности.
- •3.2.Субстратная специфичность. Специфичность пути превращения.
- •Специфичность пути превращения
- •6.2. Линеризация уравнения Михаэлиса-Ментен
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Регуляция белковыми ингибиторами
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •4. Строение, состав и физиологическая роль клеточной стенки и цитоплазматической мембраны.
- •Функции мембран
- •Мембранные липиды. Образование липидного бислоя мембран.
- •Мембранные белки. Жидко-мозаичное строение мембран
- •Функции мембранных гликолипидов, гликопротеинов, белков:
- •Свойства биологических мембран
- •Пассивный транспорт
- •Активный транспорт
- •Экзо- и эндоцитоз
- •Системы унипорта, симпорта и антипорта
- •4.3. Строение клеточной стенки грамположительных и грамотрицательных бактерий.
- •5. Пути и механизмы преобразования энергии в живых системах
- •5.1. Метаболизм. Катаболизм и анаболизм
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Субстратное и окислительное фосфорилирование
- •Организация дыхательной цепи в митохондриях
- •Механизм сопряжения окисления и фосфорилирования
- •Строение атф-синтазы и синтез атф
- •Коэффициент окислительного фосфорилирования
- •Дыхательный контроль
- •Энергетический обмен и теплопродукция
- •5.4. Фотосинтез и хемосинтез. Фотосинтез
- •Световая стадия фотосинтеза
- •Механизм световой фазы фотосинтеза
- •Темновая фаза фотосинтеза
- •Хемосинтез
- •6. Основные метаболические пути углеводов.
- •6.1. Общая схема превращения глюкозы. Метаболизм глюкозы в печени
- •Энергетический выход аэробного распада глюкозы
- •6.3. Пентозфосфатный путь.
- •Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.4. Брожение.
- •6.5. Биосинтез глюкозы. Обходные пути глюконеогенеза. Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.6. Биосинтез глюкозы из двухуглеродных соединений (глиоксилатный цикл).
- •7. Обмен липидов.
- •7.1. Катаболизм глицерина.
- •Окисление до со2 и образование атф
- •7.3. Биосинтез липидов.
- •8. Обмен белков
- •8.1. Общая схема метаболизма аминокислот. Механизмы транспорта аминокислот в клетку. Метаболизм аминокислот в печени
- •8.2. Дезаминирование аминокислот: окислительное дезаминирование, трансаминирование, непрямое дезаминирование (трансдезаминирование).
- •8.3. Превращения углеродного скелета аминокислот. Кетогенные и гликогенные аминокислоты.
- •8.4. Декарбоксилирование аминокислот. Биогенные амины.
- •8.5. Азотфиксация.
- •8.6. Биосинтез заменимых и незаменимых аминокислот.
- •9. Вторичные метаболиты бактерий и растений
- •Библиография
Регуляция белковыми ингибиторами
Одним из важнейших примеров регуляции белковыми ингибиторами является регуляция протеинкиназ - ферментов, фосфорилирующих белки. Протеинкиназа в активной форме представляет собой белок, построенный из одной полипептидной цепи (субъединица С). В клетке имеется белок (субъединица R), способный соединяться с белком С, причем образуется тетрамерный комплекс R2C2. Этот комплекс не обладает ферментативной активностью. Активация происходит при участии цАМФ, который связывается с субъединицей R. После связывания изменяется конформация белка, и сродство субъединицы R к субъединице С уменьшается - происходит диссоциация комплекса:
R2C2 + 2цАМФ R2цАМФ2 + 2С
Повышение концентрации цАМФ в клетке ведет к активации протеинкиназ.
Аллостерическая регуляция
Последовательность реакций синтеза сложного природного соединения из простых называется анаболическим путем, а последовательность реакций его распада - катаболическим путем. Катаболические и анаболические пути одного итого же вещества не совпадают полностью. Как правило, биохимические реакции, различающиеся в катаболическом и анаболическом путях, катализируются ключевыми аллостерическими ферментами, которые называют также регуляторными. Благодаря существованию таких ферментов возможно независимое регулирование процессов синтеза и распада.
А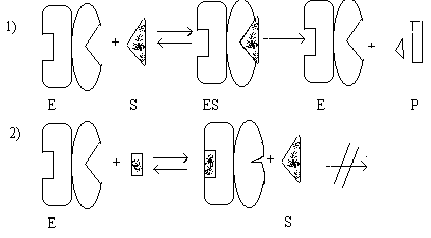 ллостерические
ферменты помимо активного центра имеют
еще специфический регуляторный центр
(аллостерический центр), с которым могут
специфически связываться некоторые
соединения, способные активировать или
ингибировать ферменты (аллостерические
модификаторы или эффекторы).
ллостерические
ферменты помимо активного центра имеют
еще специфический регуляторный центр
(аллостерический центр), с которым могут
специфически связываться некоторые
соединения, способные активировать или
ингибировать ферменты (аллостерические
модификаторы или эффекторы).
Аллостерические ферменты, как правило, состоят из 2-х или более субъединиц. Одна субъединица имеет активный (каталитический) центр, а другая - регуляторный. На рисунке представлена схема аллостерического ингибирования фермента:
В отсутствии аллостерического ингибитора субстрат присоединяется к активному центру и происходит реакция. Если в среде есть аллостерический ингибитор, то он присоединяется к регуляторному центру, что ведет к изменению конформации регуляторной субъединицы, а затем - каталитической субъединицы. В результате активность фермента снижается.
Кинетика аллостерических ферментов не подчиняется уравнению Михаэлиса-Ментен. Зависимость скорости реакции от концентрации субстрата носит сигмоидальный (S-образный) характер.

Ингибирование по принципу обратной связи
И нгибирование
фермента, катализирующего одну из
реакций в цепи, конечным продуктом этой
цепи называют ингибированием по
принципу обратной связи. В цепи
реакций биосинтеза D из
A, катализируемой ферментами
Е1, Е2, Е3, при высоких
концентрациях D обычно
наблюдается ингибирование превращения
А в В. D действует как
отрицательный аллостерический эффектор
фермента, или ингибитор, действующий
по принципу обратной связи.
нгибирование
фермента, катализирующего одну из
реакций в цепи, конечным продуктом этой
цепи называют ингибированием по
принципу обратной связи. В цепи
реакций биосинтеза D из
A, катализируемой ферментами
Е1, Е2, Е3, при высоких
концентрациях D обычно
наблюдается ингибирование превращения
А в В. D действует как
отрицательный аллостерический эффектор
фермента, или ингибитор, действующий
по принципу обратной связи.
В![]() кинетическом плане ингибирование по
принципу обратной связи может быть
конкурентным, неконкурентным.
кинетическом плане ингибирование по
принципу обратной связи может быть
конкурентным, неконкурентным.
Очень часто ингибитор, действующий по принципу обратной связи, является последней малой молекулой перед синтезом макромолекулы (например, нуклеотид в синтезе нуклеиновых кислот). Регуляция по принципу обратной связи происходит на первой функционально необратимой стадии, уникальной для данной цепи реакций биосинтеза.
Такое ингибирование позволяет экономить метаболиты и энергию, прекращая синтез продукта уже на первых стадиях.
Примером ингибирования по принципу обратной связи может быть регуляция синтеза УТФ (уридинтрифосфата).
Метаболический путь синтеза УТФ включает 8 реакций. Первая катализируется реакцией карбамоилфосфатсинтетазой II. Это аллостерический фермент: конечный продукт метаболического пути - УТФ - является его аллостерическим ингибитором.
