
- •1. Биохимия - молекулярная логика живых организмов. Состав живой материи
- •1.1. Химическая организация клетки. Основные классы биомолекул, общие принципы их строения
- •1.2. Строение и функции клетки эукариотов и прокариотов. Внутриклеточные органеллы.
- •1.3. Особенности организации биосинтетических процессов в клетках прокариот и эукариот
- •2. Аминокислоты и белки
- •Строение и классификация аминокислот
- •Стереоизомерия.
- •Кислотно-основные свойства аминокислот
- •2.2. Пептиды. Строение пептидов. Особенности пептидной связи.
- •2.3. Белки и их основные признаки. Классификации белков. Биологические функции белков и пептидов (ферменты, гормоны, транспортные белки, структурные белки, иммуноглобулины, рецепторы).
- •Классификация белков
- •Биологические функции белков
- •Пространственное расположение полипептидных цепей (Конформация пептидных цепей в белках)
- •2.6.Четвертичная структура белка. Свойства олигомерных белков. Роль четвертичной структуры в проявлении определенных функций белка.
- •К инетика оксигенирования миоглобина и гемоглобина
- •Транспорт двуокиси углерода
- •Молекулярная основа эффекта Бора
- •Регуляция 2,3-бисфосфоглицератом
- •Изофункциональные белки
- •3.Биологический катализ. Ферменты.
- •Особенности ферментов как биокатализаторов
- •Ферменты
- •Принципы построения рабочего названия фермента
- •Список ферментов
- •Механизм действия ферментов. Активный центр ферментов
- •Механизм действия ферментов (на примере фермента холинэстеразы)
- •Причины высокой каталитической активности.
- •3.2.Субстратная специфичность. Специфичность пути превращения.
- •Специфичность пути превращения
- •6.2. Линеризация уравнения Михаэлиса-Ментен
- •Зависимость скорости ферментативной реакции от температуры
- •Зависимость скорости ферментативной реакции от рН
- •Обратимое конкурентное ингибирование аналогами субстрата
- •Обратимое неконкурентное ингибирование
- •Необратимое ингибирование
- •Регуляция количества фермента путем регуляции скорости его синтеза и распада
- •Превращение ферментов в активные формы
- •Регуляция активности ферментов путем их ковалентной модификации
- •Регуляция белковыми ингибиторами
- •Аллостерическая регуляция
- •Ингибирование по принципу обратной связи
- •4. Строение, состав и физиологическая роль клеточной стенки и цитоплазматической мембраны.
- •Функции мембран
- •Мембранные липиды. Образование липидного бислоя мембран.
- •Мембранные белки. Жидко-мозаичное строение мембран
- •Функции мембранных гликолипидов, гликопротеинов, белков:
- •Свойства биологических мембран
- •Пассивный транспорт
- •Активный транспорт
- •Экзо- и эндоцитоз
- •Системы унипорта, симпорта и антипорта
- •4.3. Строение клеточной стенки грамположительных и грамотрицательных бактерий.
- •5. Пути и механизмы преобразования энергии в живых системах
- •5.1. Метаболизм. Катаболизм и анаболизм
- •Макроэргические соединения
- •Фазы освобождения энергии из питательных веществ
- •Роль высокоэнергетических фосфатов в улавливании энергии. Субстратное и окислительное фосфорилирование
- •Организация дыхательной цепи в митохондриях
- •Механизм сопряжения окисления и фосфорилирования
- •Строение атф-синтазы и синтез атф
- •Коэффициент окислительного фосфорилирования
- •Дыхательный контроль
- •Энергетический обмен и теплопродукция
- •5.4. Фотосинтез и хемосинтез. Фотосинтез
- •Световая стадия фотосинтеза
- •Механизм световой фазы фотосинтеза
- •Темновая фаза фотосинтеза
- •Хемосинтез
- •6. Основные метаболические пути углеводов.
- •6.1. Общая схема превращения глюкозы. Метаболизм глюкозы в печени
- •Энергетический выход аэробного распада глюкозы
- •6.3. Пентозфосфатный путь.
- •Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.4. Брожение.
- •6.5. Биосинтез глюкозы. Обходные пути глюконеогенеза. Биосинтез глюкозы (глюконеогенез)
- •Субстраты для глюконеогенеза
- •Биосинтез гликогена (гликогенез)
- •Распад гликогена (гликогенолиз)
- •П ревращение в жирные кислоты и холестерол
- •6.6. Биосинтез глюкозы из двухуглеродных соединений (глиоксилатный цикл).
- •7. Обмен липидов.
- •7.1. Катаболизм глицерина.
- •Окисление до со2 и образование атф
- •7.3. Биосинтез липидов.
- •8. Обмен белков
- •8.1. Общая схема метаболизма аминокислот. Механизмы транспорта аминокислот в клетку. Метаболизм аминокислот в печени
- •8.2. Дезаминирование аминокислот: окислительное дезаминирование, трансаминирование, непрямое дезаминирование (трансдезаминирование).
- •8.3. Превращения углеродного скелета аминокислот. Кетогенные и гликогенные аминокислоты.
- •8.4. Декарбоксилирование аминокислот. Биогенные амины.
- •8.5. Азотфиксация.
- •8.6. Биосинтез заменимых и незаменимых аминокислот.
- •9. Вторичные метаболиты бактерий и растений
- •Библиография
8. Обмен белков
8.1. Общая схема метаболизма аминокислот. Механизмы транспорта аминокислот в клетку. Метаболизм аминокислот в печени
Б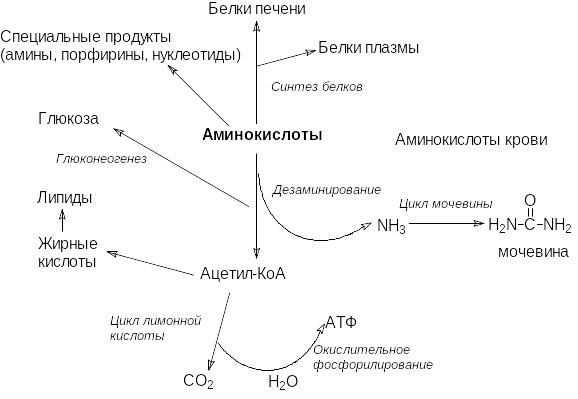 елки
перевариваются в желудочно-кишечном
тракте до аминокислот. Аминокислоты,
всосавшиеся в кишечнике и поступившие
затем в печень, также имеют несколько
путей метаболизма. Аминокислоты являются
важнейшими субстратами метаболизма
азота. От аминокислот берут начало
белки, ферменты, пуриновые и пиримидиновые
основания (и нуклеиновые кислоты),
пиррольные производные (порфирины),
биологически активные соединения
пептидной природы (гормоны), а также ряд
других соединений.
елки
перевариваются в желудочно-кишечном
тракте до аминокислот. Аминокислоты,
всосавшиеся в кишечнике и поступившие
затем в печень, также имеют несколько
путей метаболизма. Аминокислоты являются
важнейшими субстратами метаболизма
азота. От аминокислот берут начало
белки, ферменты, пуриновые и пиримидиновые
основания (и нуклеиновые кислоты),
пиррольные производные (порфирины),
биологически активные соединения
пептидной природы (гормоны), а также ряд
других соединений.
Транспорт в другие ткани
Аминокислоты из печени могут поступать в систему кровообращения и таким образом доставляться в другие органы и ткани, а там использоваться в качестве строительных блоков для биосинтеза тканевых белков.
Биосинтез белков печени и плазмы крови
Белки печени подвергаются постоянному обновлению, причем для них характерна очень высокая скорость оборота со средним периодом полужизни всего несколько дней. Кроме того, именно в печени синтезируется большинство белков плазмы крови.
Дезаминирование и распад
Участие в цикле глюкоза-аланин
Спустя несколько часов после приема пищи из мышц в печень поступает аланин, который подвергается деаминированию, а образующийсяпируват превращается в глюкозу. Дефицит аминокислот в мышцах пополняется после еды.
Превращение в нуклеотиды и другие продукты
Аминокислоты служат предшественниками в синтезе пуриновых и пиримидиновых оснований нуклеотидов, а также в синтезе некоторых специализированных веществ.
Окситоцин и вазопрессин – циклические пептиды гормонального действия.
Глутатион – трипептид, участвующий в системе обезвреживания ксенобиотиков.
Серотонин, гистамин – биогенные амины.
Меланин – пигмент кожи.
Адреналин – гормон.
Холин – предшественник нейромедиатора и фосфолипидов.
Креатин – предшественник креатинфосфата.
Порфирины.
Коферменты.
8.2. Дезаминирование аминокислот: окислительное дезаминирование, трансаминирование, непрямое дезаминирование (трансдезаминирование).
Те аминокислоты, которые не были использованы в печени или других органах для биосинтеза белков, подвергаются дезаминированию и с образованием ацетил-КоА и промежуточных субстратов цикла лимонной кислоты.
Чаще всего удаление
аминогруппы достигается переаминированием,
в ходе которого аминогруппа аминокислоты
переносится на -кетоглутаровую
кислоту, которая в результате превращается
в глутаминовую кислоту. Затем специфическими
дегидрогеназами глутаминовая кислота
дезаминируется с о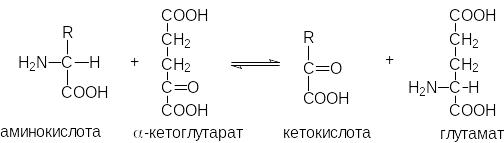 бразованием
на -кетоглутаровой
кислоты и аммиака.
бразованием
на -кетоглутаровой
кислоты и аммиака.
П![]() ереаминирование
аминокислот является важным связующим
звеном между метаболизмом аминокислот
(белков) и сахаров. В этот процесс
вовлечены заменимые гликогенные
аминокислоты, которые превращаются в
гликоген за счет глюконеогенеза через
ряд промежуточных продуктов цикла
лимонной кислоты.
ереаминирование
аминокислот является важным связующим
звеном между метаболизмом аминокислот
(белков) и сахаров. В этот процесс
вовлечены заменимые гликогенные
аминокислоты, которые превращаются в
гликоген за счет глюконеогенеза через
ряд промежуточных продуктов цикла
лимонной кислоты.
Углеродные атомы аминокислот могут включаться в общий путь катаболизма шестью путями:
А) из глицина, серина, цистеина, аланина, треонина образуется пируват (гликогенные аминокислоты)
Б) из лизина, тирозина, фенилаланина, лейцмна и триптофана образуется ацетил-КоА через ацетоацетил-КоА (кетогенные аминокислоты)
В) глутамин, глутамат, гистидин, пролин, аргинин вкючаются через -кетоглутарат
Г) четыре углеродных атома фенилаланина и тирозина включаются через фумарат
Д) метионин, изолейцин и валин включаются через сукцинил-КоА
Е) аспартат и асрарагин образуют оксалоацетат.
Аммиак, образующийся при дезаминировании, токсичен для организма и выводится в виде различных соединений. У человека конечным продуктом является мочевина. Мочевина образуется в результате процесса, который получил название цикла мочевины. Для биосинтеза мочевины требуется две молекулы аммиака. Источником аммиака первой реакции служит окислительное дезаминирование глутаминовой кислоты, для второй испрользуется аммиак аспарагиновой кислоты, которая образуется из глутаминовой путем переаминирования с оксалоацетатом.
