
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
Диастереомерия
В введении диастереомеры были определены как стереоизомеры, которые не относятся друг к другу, как предмет к своему зеркальному изображению. Рассмотрим четыре стереоизомерные структуры 2,3,4-тригидроксибутаналя.

Эти структуры представляют четыре возможных комбинации двух неэквивалентных хиральных центров. Конфигурации у атомов С2 и С3 обозначены по Кану – Ингольду – Прелогу. Каждая структура является стереоизомером по отношению к любой другой. 2R,3R- и 2S,3S-изомеры являются энантиомерами, так же как и пара 2S,3R- и 2R,3S-изомеров. 2R,3R-изомер является диастереомером по отношению к 2R,3S-изомеру, так как эта пара представляет собой пару стереоизомеров, но не энантиомеров. Зеркальным изображением 2R,3R-изомера является 2S,3S-изомер, а любой объект может иметь только одно зеркальное изображение.
В отличие от энантиомеров диастереомеры могут иметь различные температуры плавления, температуры кипения, показатели преломления, растворимость, дипольные моменты и т. д., при реакции с определенным реагентом они могут давать различные вещества. Оптическое вращение диастереомеров может отличаться как по величине, так и по знаку.
Обозначение конфигураций диастереомеров довольно просто. Каждый хиральный центр получает обозначение R или S в соответствии с правилами старшинства по системе Кана – Ингольда – Прелога.
В относительно простых случаях на системы с более чем с одним асимметрическим центром распространяют правила Фишера, основанные на структуре и номенклатуре углеводов. Эти правила можно проиллюстрировать на примере уже рассмотренных стереоизомеров 2,3,4-тригидроксибутаналя- 2R,3R- и 2S,3S-Изомеры представляют собой соответственно D- и L-эритрозы. 2S,3R- и 2R,3S-изомеры — соответственно D- и L-треозы. Эти проекционные формулы Фишера приведены ниже:

По правилу Фишера определенный стереохимический ряд обозначается D или L в зависимости от того, аналогична ли конфигурация асимметрического центра с наибольшим номером D- или L-глицериновому альдегиду. При распространении правила Фишера на соединения с двумя асимметрическими центрами используют приставки эритро- и трео- для описания относительной конфигурации двух центров, когда аналогии между заместителями очевидны.
Если молекула имеет два идентично замещенных хиральных центра, число стереоизомеров уменьшается с 4-х до 3-х, что хорошо известно для винной кислоты. Эти три изомера: D- и L-формы (энантиомеры) и диастереомерная мезо-форма. Мезо-форма совместима со своим зеркальным изображением, так как она имеет плоскость симметрии; она ахиральна и оптически неактивна. Ниже приведены три возможных стереоизомера винной кислоты:

Введение хиральных центров в циклические структуры приводит к некоторым интересным следствиям. Если в качестве примера взять диметилциклоалканы, то окажется, что цис-изомеры ахиральны, так как имеют плоскость симметрии. транс-Диметилциклоалканы хиральны, если число звеньев в кольце нечетное. Если в цикле четное число звеньев, то будет ли он хиральным или ахиральным зависит от характера замещения. Эти стереохимические особенности заметны при рассмотрении диметилциклопропанов и диметилциклобутанов. Три возможных стереоизомера 1,2-диметилциклопропана:

Три возможных стереоизомера 1,2-диметилциклобутана:
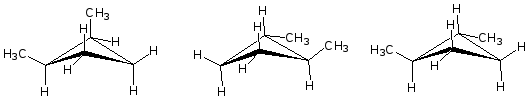
Два возможных стереоизомера 1,3-диметшщиклобутана:
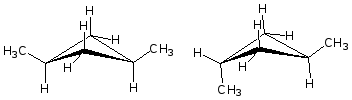
Для 1,2-диметшщиклопропана и 1,2-диметилциклобутана возможно существование трех стереоизомеров: мезо-формы (цис-) и пары энантиомеров (транс-). Для 1,3-диметилциклобутана возможно только два стереоизомера, оба они ахиральны. 1,3-цис-Изомер имеет две плоскости симметрии: одна проходит через С1 и С3, другая через С2 и С4. 1,3-транс-Изомер имеет плоскость симметрии, проходящую через С1 и С3. Если продолжить рассмотрение стереохимии системы транс-1,3-диметилциклобутана, можно подметить некоторые другие интересные особенности. Посмотрим, что произойдет, если ввести заместители при С2 и С4. Если эти заместители находятся в цис-положении по отношению друг к другу, то плоскость симметрии сохраняется, и молекула ахиральна. Если заместители находятся в транс-положении друг к другу, то плоскость симметрии исчезает. Хирален ли транс-2,4-дибром-транс-1,3-диметилциклобутан? Рассмотрение молекулы к ее зеркального изображения показывает, что они совместимы.
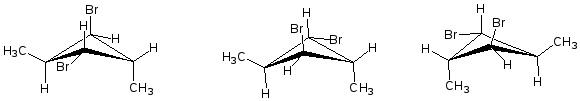
Это пример молекулы, которая имеет центр симметрии — в этом случае совпадающий с центром циклобутанового кольца. Пример иллюстрирует важное взаимоотношение симметрии и хиральности: молекула с центром симметрии совместима со своим зеркальным изображением и поэтому ахиральна.
Как видно из этих примеров, для молекул, имеющих более одного хирального центра, нет простых правил, связывающих число хиральных центров с числом стереоизомеров, так как некоторые из форм могут быть совместимы с их зеркальными изображениями. При отсутствии таких осложнений число стереоизомеров, возможных для системы с n асимметрических центров равно 2n.
Диастереомерные взаимоотношения дают основу для ряда важных процессов. Расщепление — это разделение смеси равных количеств энантиомеров (называемой рацематом или рацемической смесью) на ее компоненты. Разделение обычно достигается превращением смеси энантиомеров в смесь диастереомеров действием оптически активного реагента (расщепляющего реагента). Поскольку диастереомеры имеют различные физические и химические свойства, их можно разделить удобными методами и затем на следующей стадии регенерировать энантиомеры. Альтернативный метод расщепления основывается на различиях в скоростях реакций энантиомеров с хиральным агентом. Энергии переходных состояний для реакций одной хиральной молекулы с другой могут быть для энаитиомеров различны. Если рацемическая смесь (R-молекула + S-молекула) реагирует с оптически активным реагентом (R-реагент), то два переходных состояния (R-молекула-•••-R-реагент и S-молекула ••• R-реагент) являются диастереомерными. Разделение энантиомеров селективной реакцией с оптически активным реагентом называют кинетическим расщеплением. Ферменты являются очень эффективными и селективными катализаторами разнообразных биологических превращений. Во многих из этих превращений участвуют хиральные субстраты, и в этом случае обычно наблюдается, что один энантиомер значительно реакционноспособнее другого. Причина этого состоит в том, что сами ферменты хиральны и взаимодействие фермента с одним энантиомером диастереомерно по отношению к взаимодействию этого же фермента с другим энантиомером; таким образом, одно взаимодействие фермент — субстрат преобладает над другими. Реакции, катализируемые ферментами, используются для расщепления органических молекул, когда один энантиомер является предпочтительным субстратом для фермента.
Как говорилось ранее, геометрические изомеры алкенов в общем представляют собой диастереоизомеры, поскольку они являются стереоизомерами, но не энантиомерами. Обычное обозначение геометрических изомеров как цис- или транс- глубоко укоренилось, но оно страдает той же неопределенностью, что и правила Фишера, так как основано на аналогиях, которые не всегда очевидны.
При решении проблемы обозначения геометрических изомеров также используется правило последовательности, оно получает все более широкое применение.
Основным критерием снова является атомный номер. Четыре заместителя у двойной углерод-углеродной связи рассматриваются попарно и сравниваются следующим образом: расположены ли заместители с большим атомным номером из каждой пары по одну или по разные стороны двойной связи. Если они находятся по одну сторону, используют обозначение Z (нем. zusammen — вместе). Если же они находятся по разные стороны, то используют обозначение Е (нем. entgegen — напротив). Так же как при применении правила старшинства к хиральным центрам, если атомы, непосредственно связанные с двойной связью, имеют одинаковый атомный номер, то старшинство определяется сравнением атомов, присоединенных к атомам первого слоя. Система может быть также применена в случае других кратных связей, таких как, например, C=N. Она предпочтительнее, чем обозначения син- и анти-, используемые для изомеров оксимов. Как и в случае хиральных центров, если атом двойной связи не имеет двух заместителей (как в оксимах), то используется «фантом» — лиганд с нулевым атомным номером.
