
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
Правила резонанса
При написании конических структур и выводе истинной структуры молекулы руководствуются следующими правилами:
а) все канонические формы обязательно должны быть структурами Льюиса;
б) во всех структурах положение ядер должно быть одинаковым. Это означает, что при написании канонических форм можно менять только распределение электронов;
в) все атомы, участвующие в резонансе, должны лежать практически в одной плоскости (условие копланарности). Условие копланарности связано с необходимостью максимального перекрывания р-орбиталей;
г) все канонические формы должны иметь одинаковое число неспаренных электронов;
д) энергия истинной молекулы меньше энергии любой из канонических структур, т. е. делокализация является стабилизирующим фактором;
е) вклад отдельных канонических форм в истинную структуру молекулы неодинаков; он пропорционален их устойчивости; наиболее устойчивая форма дает наибольший вклад.
Правила для оценки устойчивости воображаемых структур:
а) чем больше ковалентных связей содержит структура, тем она устойчивее;
б) чем в большей степени разделены разноименные заряды, тем меньше устойчивость структуры;
в) структуры, имеющие больше двух формальных зарядов, обычно дают очень незначительный вклад в резонанс. Особенно неэффективны структуры, имеющие одноименные заряды на соседних атомах;
г) чем больше электроотрицательность атома, несущего отрицательный заряд, тем более устойчива структура в целом. То же самое относится к структурам, имеющим положительный заряд на атомах с низкой электроотрицательностью;
д) значительное изменение обычных длин связей или валентных углов приводит к снижению устойчивости структуры.
Типы молекул с делокализованными связями
1. Сопряженные двойные (или тройные) связи. Примером может служить молекула акролеина.
![]()
2. Двойные (или тройные) связи, сопряженные с р-орбиталью соседнего атома. Если атом, соседний с двойной связью, имеет р-орбиталь, возникает система из трех р-орбиталей, которые, перекрываясь, образуют три МО.
Различают три случая: исходная р-орбиталь может содержать два электрона, один или ни одного электрона. Это системы типа аллильного аниона, радикала и катиона.
Аллильный анион

Аллильный свободный радикал

Аллильный катион
![]()
Кроме того, возможно сопряжение кратной связи с нейтральными атомами, несущими неподеленную пару электронов.
![]()
3. Сверхсопряжение, или гиперконъюгация, происходит при участии - электронов.
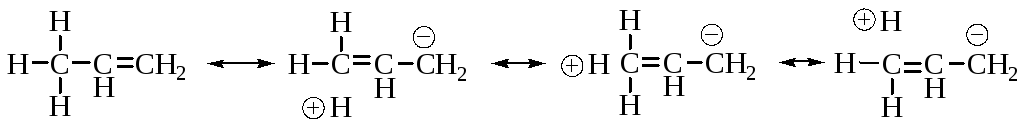
Гиперконъюгация в нейтральных молекулах имеет незначительный вклад, но в карбокатионах ее влияние бывает основным стабилизирующим фактором.
Ароматичность
Особый случай систем с делокализованными связями – системы с циклическим сопряжением. Для молекул, имеющих цикл из чередующихся двойных (или тройных) и одинарных связей, существует три возможных случая.
1. Циклическая
система в силу тех или иных причин не
плоская, т. е. в ней нет единой цепи
сопряжения. В таких случаях свойства
соединений не отличаются от свойств
ациклических полиенов и их называют
неароматическими.
Рисунок 4 Внешнее и индуцированное магнитное поле у ароматического кольца.
2. Плоские циклические системы, имеющие в цепи сопряжения 4n+2 электронов (число Хюккеля), называются ароматическими. Такие соединения обычно обладают большой устойчивостью, для них более характерны реакции замещения, а не присоединения, т. е. они стремятся сохранить свой ненасыщенный характер. Такие вещества способны удерживать индуцированный кольцевой ток, это свойство называется диатропностью и является одним из важнейших критериев ароматичности. Существует несколько методов, позволяющих установить наличие диатропных свойств. Наиболее важный метод основан на измерении химического сдвига протонов в ЯМР-спектре. При наложении магнитного поля в ароматических молекулах возникают кольцевые токи -электронов, которые индуцируют вторичное поле, направленное на усиление внешнего поля с наружной стороны кольца, и на ослабление с внутренней. В результате сигналы протонов, находящихся снаружи, смещаются в слабое поле, а внутри в сильное (рис. 4). Так обычные значения химического сдвига олефиновых атомов водорода – 4-5 м.д., а ароматических – 7-8 м.д.
3. Плоские циклические системы с числом электронов, равным 4n (число Мёбиуса), обладают антиароматическими свойствами. Соединения такого типа дестабилизированы резонансом и очень неустойчивы.
