
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
Влияние различных факторов на реакционную способность в реакции se
Влияние структуры субстрата
Электронодонорные группы понижают, а электороноакцепторные повышают скорость реакции SE1, что связано с порядком устойчивости карбанионов. В случае механизмов SE2 стоит ожидать, что реакционная способность алкильных производных аналогична реакционной способности в SN2, то есть СН3> R-CH2> R2CH> R3C, что действительно наблюдается во многих реакциях.
Для реакций SE2(с фронта) установлено, что -разветвление повышает, а -разветвление понижает скорость реакции.
Влияние строения уходящей группы (электрофуга)
Чем более полярна связь С–Х, тем легче отщепляется электрофуг. Если уходящая группа многовалентный металл, на скорость реакции существенное влияние оказывают другие заместители. Чем больше электроотрицательность группы W, тем меньше полярность связи C–Me–W и тем менее устойчив катион (MeW)+, так, например, HgCl+ худшая уходящая группа, чем HgR+.
Влияние природы растворителя
Повышение полярности растворителя увеличивает скорость SE1, по-разному оказывает влияние на механизмы SE2 и почти не оказывает влияния на механизмы Si. Влияние полярности растворителя основано на тех же принципах, что и для механизмов SN, т.е. те растворители, которые стабилизируют переходное состояние в большей степени, чем исходные реагенты, ускоряют реакцию, и наоборот.
Ароматическое электрофильное замещение
Реакции SEAr изучены значительно лучше, чем реакции алифатического SE.
Известно два механизма ароматического электрофильного замещения. Наиболее важным является бимолекулярный механизм, включающий две стадии:
1)присоединение электрофила, которым может быть положительно заряженная частица или часть диполя:
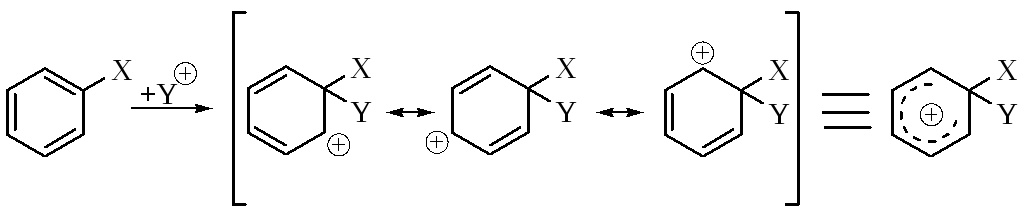

2) стадия – отщепление электрофуга:
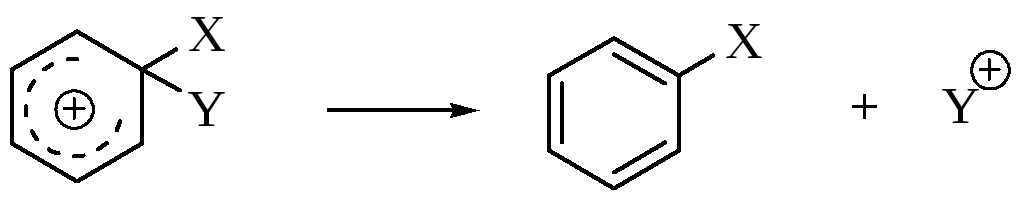
Доказательства механизма SЕ2Ar. Отсутствие изотопного эффекта. Если протон отщепляется до или во время атаки электрофила, должен наблюдаться значительный изотопный эффект, но этого не наблюдается, что свидетельствует о том, что первая стадия лимитирующая. В некоторых случаях удается выделить интермедиаты – карбокатионы в виде солей.

В системе HF–SbF5–SO2ClF–SO2F2 при температурах меньше 100 К удается получать и изучать спектры многих более простых аренониевых катионов.
Другой механизм ароматического электрофильного замещения аналогичен SE1. Он встречается исключительно редко и включает две стадии: образование арениевого аниона и последующее просоединение электрофильной частицы.

Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
В реакциях SEAr монозамещенных бензолов новая группа может вступать в орто-, мета- и пара-положения, а реакция может протекать быстрее или медленнее, чем с бензолом в зависимости от характера заместителя. Группы, которые увеличивают скорость реакции, называют активирующими, а которые замедляют скорость, – дезактивирующими. Одни группы ориентируют замещение в мета-, другие в орто- и пара-положения. Влияние различных групп основано на резонансных эффектах и эффекте поля, поскольку с ними связана устойчивость аренониевых ионов.

В каждом ионе кольцо несет положительный заряд, следовательно, любая группа Z, обладающая электронодонорным эффектом поля (+I), должна стабилизировать все три иона, а группа, обладающая электроноакцепторным эффектом поля (-I), должна дестабилизировать все три иона. В соответствии с этими эффектами наблюдется влияние групп на реакционную способность. Воздействие +I- и -I-эффектов быстро убывает с расстоянием и наиболее значительно для атомов, непосредственно связанных с группой Z. В случае мета-изомера ни одна из резонансных структур не имеет положительного заряда у атома углерода, связанного с группой Z, поэтому группы, проявляющие +I-эффект – орто- и пара-ориентанты, а группы, проявляющие -I-эффекты – мета-ориентанты, т. к. орто- и пара-положения дезактивируются в большей степени, чем мета-положения. Во многих случаях группа Z в орто- и пара-положениях участвует в резонансе с ароматическим кольцом.

Это взаимодействие оказывает значительное влияние на стабильность аренониевого катиона и действует в этих случаях в том же направлении, что и полярный эффект, в других – в противоположном. Как правило, дополнительные структуры с участием группы Z вносят больший вклад в резонансный гибрид, поэтому резонансный эффект имеет большее значение, чем эффект поля.
Все заместители Z делятся на три типа:
- содержащие электронную пару на атоме соединенном с кольцом: O-, NR2 , NHR, NH2, OH, OR, NHCOR, OCOR, SН, Hal. В соответствии с резонансным эфектом эти группы являются орто- и пара-ориентрующими. Кроме того, почти все они являются активирующими, хотя и имеют -I-эффект, следовательно, резонансный эффект сильнее эффекта поля. Исключение составляют галогены, полярный эффект которых сильнее резонансного и поэтому они являются дезактивирующими, оставаясь при этом орто- и пара-ориентрующими;
- не имеющие электронной пары на атоме, соединенном с кольцом, и проявляющие -I-эффект: NR3, NO2, CN, SO3H, CHO, COR, CO2H, CO2R, CONH2, CCl3. Эти группы в соответствии с -I-эффектом и отсутствием резонансного эффекта являются мета-ориентирующими и дезактивирующими.
- не имеющие электронной пары на атоме, соединенном с кольцом и проявляющие +I-эффект: Alk, Ar и CO2-. Они в соответствии с +I-эффектом орто- и пара-ориентирующие и активирующие.
