
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
Элетроциклические реакции
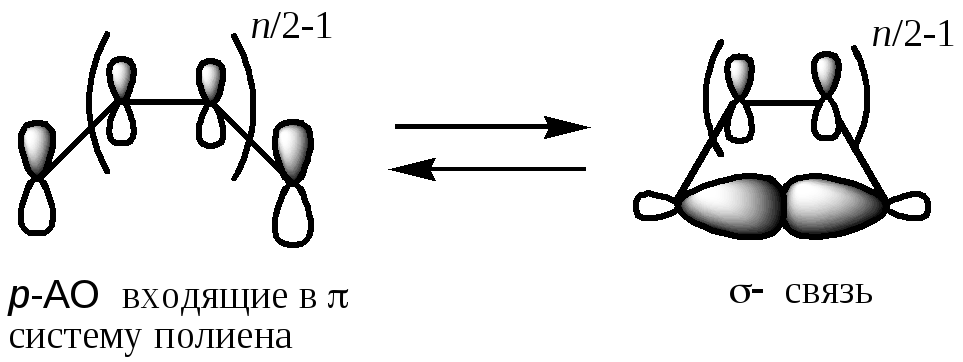
В ходе электроцикличесой реакции происходит образование σ-связи между концевыми атомами сопряженной системы π-свзей. Также возможен и обратный процесс разрыва σ-связи в сопряженном n-членном цилополиене с числом кратных связей (n/2-1), ведущий к линейному нециклическому полиену с чилом кратных связей n/2. Как и циклоприсоединение, электроциклические рекции могут быть осуществлены или при нагревании, или при обучении УФ-светом.
В ходе реакции цилизации данного типа концевые p-АО поворачиваются на ~90º, перегибридизовываются и в результате дают σ-связь, образованную sp3-гибридидными орбиталями.
Поворот концевых π-орбиталей вокруг концевых скелетных σ-связей может осуществляться в одном направлении, когда оба конца молекулы вращаются в одном направлении по или против часовой стрелке или в разных направлениях, когда один конец вращается по часовой стрелке, а другой – против. Первый способ замыкания цикла называется конротаторным, а второй дисротаторным. Для обратной реакции – ретроциклизации также возможны четыре пути:

Путь реакции однозначно определят стериохимию конечного продукта:

Для определения какой из путей электроциклической реакции реализуется, сформулированы следующие правила:
1. Термические (4q+2)-электронные электроциклические реакции происходят дисротаторно (q=0,1,2,3).
2. Термические (4r)-электронные электроциклические реакции происходят конротаторно (r=1,2,3).
3. Фотохимические (4q+2)-электронные электроциклические реакции происходят конротаторно (q=0,1,2,3).
4. Фотохимические(4r)-электронные электроциклические реакции происходят дисротаторно (r=1,2,3).
Ен-реакции
В ходе ен-реакции подвижный аллильный водород присоединяется по кратной связи. В ходе реакции одна π-связь превращается в σ-связь, но в отличие от электроциклических реакций как правило не происходит ни разрыва, ни создания циклической системы.

Ен-реакции проходят легче, когда водородпринимающий реагент, или "енофил", является электрофильным. Так, например, реакции а) и б) проходят в более мягких условиях чем в), несмотря на то, что последняя является внутримолекулярной.


Приемер реакции г) демонстрирует, что енольный таутомер, даже в низкой концентрации, может являться донором водорода в ен-реакции. Реакция д) - один из многих примеров использования в ен-реакциях катализа кислотой Льюиса. Катализируемое кислотой взаимодействие простых альдегидов с алкенами, приводящее к аллильным спиртам, 1,3-диолами или 1,3-диоксанам известно как реакция Принса.
Внутримолекулярная ен-реакция может проходить по разному в зависимости от относительной ориентации "Енового" (C=C-Z-H) и "енофильного" (X=Y) фрагментов в реагирующей молекуле. Самой обычной ориентацией является Тип 1, в котором енофил присоединен углеродной цепью к дальнему (относительно группы Z-H) углероду кратной связи. В ориентации Типа 2 енофил присоединен углеродной цепью к тому же атому углерода кратной связи, что и Z-H группа. Тип 3 предполагает, что енофил связан углеродной цепью непосредственно с атомом Z.

Большинство внутримолекулярных ен-реакций, включая описанные выше, относятся к Типу 1.
В качестве примера ен-реакции Типа 2, можно привести трансанулярный процесс в которм енофилом является карбонильная группа, а Ен-фрагмент включает метильный заместитель цикла.

Следующие уравнения демонстрируют редкий пример ен-реакции типа 3, приводящей к смеси изомеров.

Фактически реализуется две различные ен-реакции а) и б), которые отличаются положением двойной связи в продукте реакции и происхождением подвижного атома водорода.
