
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
Кислоты и основания Льюиса
Почти одновременно с Бренстедом Льюис предложил более широкую теорию кислот и оснований. Согласно этой теории:
основание – соединение с доступной парой электронов, либо неподеленной, либо находящейся на -орбитали;
кислота – любая частица с вакантной орбиталью (это может быть даже вакантная разрыхляющая орбиталь, или ).
В кислотно-основной реакции Льюиса электронная пара основания образует ковалентную связь с вакантной орбиталью кислоты, что в общем виде можно выразить уравнением:
А + :В = А-В (заряды не показаны).
Преимущество теории Льюиса состоит в том, что с ее помощью можно коррелировать поведение гораздо большего числа процессов. Например, такие соединения, как AlCl3 и BF3, являются кислотами Льюиса, поскольку, имея шесть электронов на внешней оболочке, они способны принять электронную пару. К кислотам Льюиса относятся и такие простые катионы, как, например, Аg+. Все реакции, в которых химическая связь образуется в результате взаимодействия частицы, имеющей заполненную орбиталь, с частицей, имеющей вакантную, могут рассматриваться как кислотно-основные реакции Льюиса.
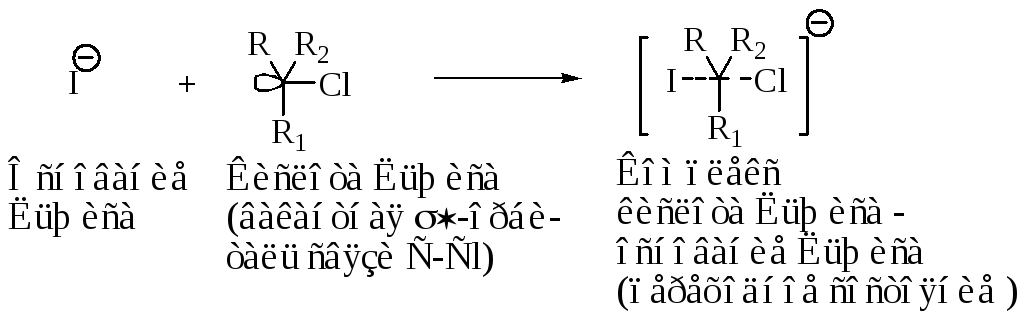

Для кислот Льюиса невозможно составить таблицу кислотности, как для кислот Бренстеда, т. к. их кислотность зависит от природы основания. Легкость протекания кислотно-основной реакции зависит, конечно, от силы кислоты и основания, но она зависит также и от другого свойства, называемого жесткостью или мягкостью кислоты или основания. Это свойство нельзя точно измерить, его можно только качественно описать. Оно имеет следующие характеристики:
Мягкие основания. Атомы-доноры имеют низкую электроотрицательность и высокую поляризуемость, они легко окисляются; валентные электроны удерживаются слабо.
Жесткие основания. Атомы-доноры имеют высокую электроотрицательность и низкую поляризуемость; окисляются с трудом, валентные электроны удерживаются прочно.
Мягкие кислоты. Атомы-акцепторы имеют большой радиус, несут низкий положительный заряд, на валентных оболочках имеют неподеленные электронные пары (p или d). Обладают высокой поляризуемостью и низкой электроотрицательностью.
Жесткие кислоты. Атомы-акцепторы имеют малый радиус, несут высокий положительный заряд, на валентных оболочках не имеется неподеленных электронных пар. Обладают низкой поляризуемостью и высокой электроотрицательностью.
Примеры оснований и кислот Льюиса приведены в табл. 4 и 5.
Таблица 4 Основания Льиса.
|
Жесткие |
Мягкие |
Промежуточные |
|
H2O, OH-, F-, AcO-, SO42-, Cl-, CO32-, NO3-, ROH, RO-, ROR, NH3, RNH2 |
RSR, RSH, RS-, J-, R3P, (RO)3P, CN-, RCN, CO, C2H4, C6H6, H-, R- |
ArNH2, C5H5N, N3-, Br-, NO2- |
Таблица 5 Кислоты Льюиса.
|
Жесткие |
Мягкие |
Промежуточные |
|
H+,Li+,Na+,K+,Mg2+,Ca2+,Al3+,Cr2+,Fe3+,BF3,B(OR)3,AlMe3,AlCl3,AlH3,SO3,RCO+,CO2,HX(молекулы с водородной связью) |
Cu2+,Ag2+,Pd2+,Pt2+,Hg2+,BH3,GaCl3,J2,Br2,CH2, карбены |
Fe2+, Co2+, Cu2+, Zn2+, Sn2+, Sb3+, Bi3+, BMe3, SO2, R3C+, NO+, C6H5+ |
Разделив кислоты и основания по указанным группам, можно руководствоваться простым правилом: жесткие кислоты преимущественно взаимодействуют с жесткими основаниями, а мягкие кислоты – с мягкими основаниями (принцип ЖМКО). Это правило не касается силы кислоты или основания, а говорит только о том, что комплекс А–В будет обладать дополнительной устойчивостью, если А и В относятся к одной группе. Правило не имеет теоретической основы, а является обобщением, выведенным из экспериментальных данных.
