
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
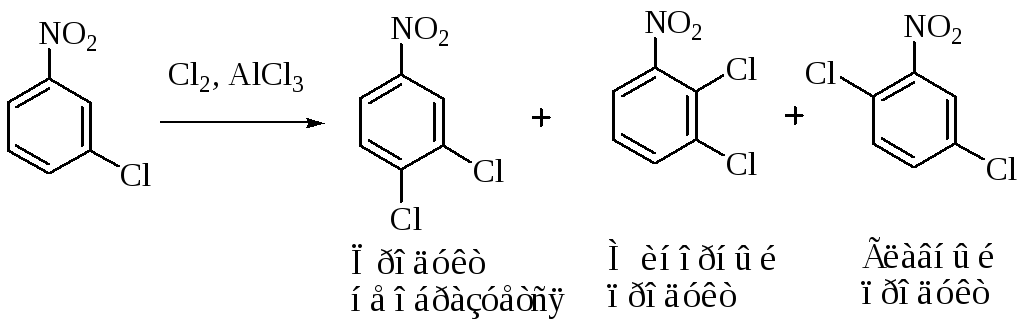
Соотношение орто- и пара-замещенных продуктов
П о
статистике соотношениеорто-
и пара-изомеров
должно быть 67:33. Однако необходимо
учитывать и другие факторы. Так, в
бензенониевом ионе А
распределение заряда таково, что
замещение в пара-положении должно быть
больше, чем в орто-,
так как стабилизирующее влияние на
пара-положение
более существенно.
о
статистике соотношениеорто-
и пара-изомеров
должно быть 67:33. Однако необходимо
учитывать и другие факторы. Так, в
бензенониевом ионе А
распределение заряда таково, что
замещение в пара-положении должно быть
больше, чем в орто-,
так как стабилизирующее влияние на
пара-положение
более существенно.
Другой важный фактор – стерический эффект. Объемные группы затрудняют атаку электрофила в орто-положение, что приводит к увеличению доли пара-изомера.

Если заместитель содержит группу, которая стабилизирует катион за счет резонанса, пара-хиноидная структура вносит больший вклад, чем орто-хиноидная и тем самым доля пара-изомера увеличивается еще больше.
Ориентация в бензольных кольцах, содержащих более одного заместителя
Для предсказания ориентации можно выделить два случая.
Две группы взаимно усиливают друг друга или оказывают согласованное действие. В этом случае трудностей с предсказанием образующегося изомера не возникает.

2.Две группы действуют несогласованно.
Часто ориентацию в таких случаях предсказать невозможно, но существуют некоторые закономерности:
- если сильноактивирующая конкурирует со слабоактивирующей или с дезактивирующей, то реакция контролируется первой. Все группы в соответствии с этим параметром располагают в следующей последовательности: NH2, OH, NR2, O-, OR, OCOR, NHCOR, R, Ar, Hal, мета-ориентанты.
Например, в орто-хлорфеноле замещение идет в орто- и пара-положение к ОН-группе;

- при прочих равных условиях третья группа обычно не входит в положение между двумя мета-группами из-за стерических препятствий;
- если мета-ориентирующая группа находится в мета-положении к орто- и пара-ориентирующей, то входящая группа занимает орто-положение по отношению к мета-ориентирующей, а не к пара-ориентирующей.
Свободнорадикальное замещение
Как правило, свободнорадикальный процесс состоит, по крайней мере, из двух стадий. Первая – образование свободных радикалов – называется стадией инициирования. Эта стадия происходит путем гомолитического разрыва связи, т.е. путем такого расщепления, когда на каждом фрагменте остается неспаренный электрон. Эта стадия может быть индуцирована нагреванием или облучением, или протекать спонтанно. В качестве источников свободных радикалов расщеплением спонтанно или при небольшом нагревании чаще всего используют пероксиды, перкислоты, а также некоторые другие органические соединения с низкой энергией связи, например, азосоединения. Из молекул, легко расщепляющихся при действии света, наиболее часто используют хлор, бром и кетоны.
Другой возможный путь образования радикалов – это одноэлектронный перенос
![]()
Вторая стадия свободнорадикального процесса – гибель свободных радикалов. Реакция происходит по пути, противоположному образованию, а именно за счет рекобинации – взаимодействия двух одинаковых или различных радикалов с образованием новой связи.
![]()
Эта стадия называется стадией обрыва цепи.
Однако не всегда обрыв цепи следует сразу за инициированием. Большинство радикалов очень реакционноспособны и вступают в реакцию с первой же доступной частицей. Поскольку концентрация свободных радикалов обычна низка, наиболее вероятно, что такой частицей будет молекула, а не другой радикал. Когда радикал взаимодействует с нейтральной молекулой, всегда получается другой радикал. Может быть два варианта реакции: присоединение или замещение:

Эти стадии называются стадиями продолжения (или роста) цепи, т. к. вновь образующийся радикал опять вступает в аналогичную реакцию до тех пор, пока не встретятся два радикала и не произойдет обрыв цепи. Описываемый процесс в целом называют цепной реакцией. Между инициированием и обрывом цепи могут осуществляться сотни и тысячи стадий роста. Длина цепи зависит от реакционной способности свободных радикалов. Так, в случае высокореакционноспособных алкильных радикалов цепи длинные, а в случае радикалов с низкой реакционной способностью, например арильных, цепи или короткие, или реакция носит не цепной характер. Всем свободнорадикальным реакциям присущи некоторые общие характеристики.
1. Реакции в целом похожи, не зависимо от того, происходят они в газовой или жидкой фазе, хотя сольватация свободных радикалов в растворе накладывает свои особенности.
2. Присутствие кислот или оснований, а также изменение полярности растворителей мало влияют на реакции, за исключением тех случаев, когда неполярные растворители могут подавлять конкурирующие ионные реакции.
3. Реакции инициируются или ускоряются в условиях генерирования свободных радикалов, например, в присутствии перекисей или при облучении.
4. Скорость реакции уменьшается или реакция полностью подавляется в присутствии веществ, улавливающих свободные радикалы, например, N2O5, O2, бензохинон. Такие вещества называют ингибиторами.
