
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
Наиболее важные сигматропные перегруппировки
Перегруппировка Коупа
Перегруппировка Коупа представляет собой [3,3]-сигматропный сдвиг.

Перегруппировка Кляйзена
Перегруппировка аллилвиниловых эфиров аналогична перегруппировке Коупа и представляет собой [3,3]-миграцию.

Синтез индола по Фишеру
Реакция включает [3,3]-сигматропный сдвиг и протекает по схеме:

Перегруппировка аллилимидов
Эти реакции протекают как [2,3]-сигматропные сдвиги.
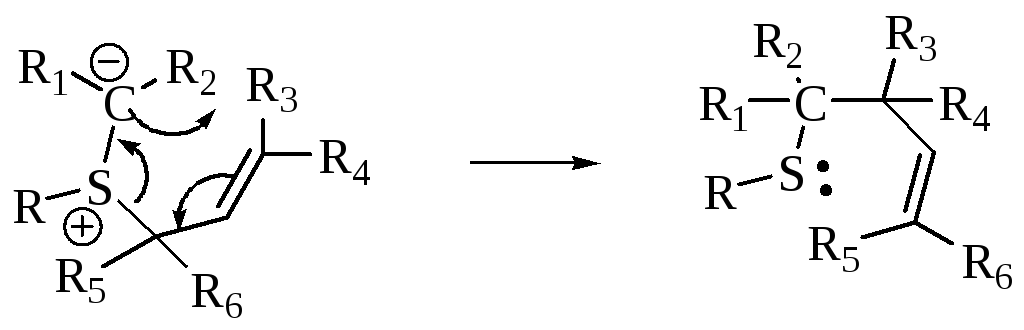

Бензидиновая перегруппировка
![]()
Механизм реакции включает [5,5]-сигматропный сдвиг.

Фотохимия Общие положения
Для протекания фотохимической реакции необходимо, чтобы соединение поглощало свет, испускаемый источником излучения. Для этого молекула должна иметь полосу поглощения (энергетические уровни), соответствующую по энергии свету, испускаемому источником. Электронные спектры поглощения органических соединений обычно состоят из довольно широких полос. В таблице 8 приведены максимумы полос поглощения с низкой энергией для некоторых типов органических соединений, фотохимия которых более всего изучена. Известен ряд источников света. Наиболее широко используют ртутные лампы, которые дают излучение при 254, 313 и 366 нм. Состав излучения можно регулировать с помощью фильтров. Например, если в системе свет проходит через стекло «Пирекс», то образца достигнет только свет с длиной волны, большей 300—310 нм, поскольку излучение более высокой энергии поглощается стеклом. Если требуется излучение более высокой энергии, то используют чистый плавленый кварц, который прозрачен до 200 нм. Для других материалов граница поглощения лежит в области между кварцем и пирексом.
Таблица 8 Максимумы поглощения некоторых классов органических соединений
|
Субстрат
|
Максимум поглощения, нм |
|
Простые алкены |
190—200 |
|
Ациклические диены |
220—250 |
|
Циклические диены |
250—270 |
|
Стиролы |
270—300 |
|
Насыщенные кетоны |
270—280 |
|
α, β-Ненасыщенные кетоны |
310—330 |
|
Ароматические кетоны и альдегиды |
280—300 |
|
Ароматические соединения |
250—280 |
Для регулирования длины волны света, падающего на образец, можно также использовать растворы, поглощающие в определенных интервалах длин волн. Когда поглощается квант света, молекула переходит в возбужденное состояние. Следует отметить две общих особенности этого процесса.
1) В момент возбуждения происходит перестройка только электронов, более тяжелые ядра сохраняют геометрию основного состояния. Это положение называют принципом Франка – Кондона.
2) В момент возбуждения не происходит инверсии спина. Инверсия запрещена правилами квантовомеханического отбора, согласно которым процесс поглощения должен протекать без изменения спина электрона.
Таким образом, в очень короткий отрезок времени (10-15 с), необходимый для возбуждения, расположение ядер в молекуле не меняется, так же как не меняется спин электрона. Однако после возбуждения эти изменения могут очень быстро произойти. Новая геометрия минимальной энергии связана со структурой возбужденного состояния, и молекула быстро принимает эту геометрию благодаря колебательным процессам. Между молекулами в возбужденном состоянии, обладающими более высокой, чем минимальная, колебательной энергией, и растворителем устанавливается термодинамическое равновесие. Иногда химические реакции возбужденной молекулы протекают быстрее по сравнению с колебательной релаксацией, но в растворе это встречается редко. Когда реакция протекает быстрее, чем колебательная релаксация, то говорят, что реакция протекает через «горячее» возбужденное состояние, т. е. состояние с избытком колебательной энергии.
Возбужденное состояние может также претерпевать интеркомбинационную конверсию, т. е. один из электронов наполовину заполненной орбитали может изменить спин, в результате чего образуется триплет, в котором оба неспаренных электрона имеют одинаковый спин. Триплетное состояние примет новую молекулярную геометрию минимальной энергии.
Общее положение можно представить для гипотетической молекулы, используя диаграмму потенциальной энергии. Для обозначения синглетного и триплетного состояний используют соответственно символы S и Т. Возбуждение является «вертикальным переходом», т. е. оно не включает изменения молекулярной геометрии. Горизонтальное перемещение на диаграмме соответствует движению атомов относительно друг друга. Поскольку кривые потенциальной энергии смещены относительно друг друга, то частицы, образующиеся после поглощения энергии, возбуждены и электронно, и колебательно. То же самое справедливо для триплетного состояния, образующегося в результате интеркомбинационной конверсии. В результате колебательной релаксации происходит переход возбужденного состояния как синглетного, так и триплетного в низшее колебательное состояние. При описании любой фотохимической реакции одним из центральных является вопрос о том, какое имеется состояние – синглетное или триплетное. Характер состояния зависит от относительной скорости интеркомбинационной конверсии по сравнению с химической реакцией возбужденного синглетного состояния. Если интеркомбинационная конверсия протекает быстро по сравнению с фотохимической реакцией, то достигается триплетное состояние. Если нет, то реакция протекает через синглетное состояние.
Фотосенсибилизация является важной альтернативой прямому возбуждению молекул; она обычно возникает в реакциях, протекающих через триплетные возбужденные состояния. Если реакцию надо провести путем фотосенсибилизации, то в дополнение к основному реагенту (реагентам) в систему добавляют специальное вещество, сенсибилизатор. Это вещество должно удовлетворять следующим критериям.
1) Должно возбуждаться используемым излучением.
2) Должно присутствовать в достаточной концентрации и поглощать достаточно сильно, значительно сильнее, чем реагирующая молекула в условиях эксперимента.
3) Должно быть способным возбуждать реагирующую молекулу путем передачи энергии.
Самым обычным случаем, является триплетная сенсибилизация. В этом случае интеркомбинационная конверсия сенсибилизатора должна протекать быстрее, чем передача энергии реагирующей молекуле.
Передача энергии должна протекать с общим сохранением спина, Обычно молекула-акцептор синглетна в основном состоянии, и ее реакция с триплетным состоянием сенсибилизатора приводит к триплетному состоянию акцептора. Реже молекула-акцептор в основном состоянии является триплетной, а возбужденное состояние, образующееся при переносе энергии от донора – триплета, в этом случае будет синглетным. Механизм триплетной фотосенсибилизации приведен ниже:
Сенс. → 1Сенс.* Образование синглетного сенсибилизатора
1Сенс.* → 3Сенс.* Интеркомбинационная конверсия сенсибилизатора
3Сенс.* + Реагент → Сенс. + 3Реагент* Передача энергии реагирующей молекуле
Как следствие критерия (3), триплетное возбужденное состояние сенсибилизатора должно иметь такую же (или большую) энергию, как и реагирующее вещество. Если это условие не соблюдается, стадия (3) в вышеприведенном механизме становится эндотермической и проигрывает в конкуренции с другими методами дезактивации 3Сенс.*.
После того как прямым переносом энергии или через сенсибилизатор образовалось возбужденное состояние реагирующего вещества, наступает стадия фотохимической реакции. Однако могут протекать конкурирующие процессы, которые вновь приводят к исходному веществу. Возбужденное состояние может вернуться в основное состояние в результате испускания света: это излучательный переход. Скорость испускания очень велика (k = 105– 109 с-1) для излучательного перехода между электронными состояниями одинаковой мультиплетности; она немного меньше (k = 103–105 с-1) для перехода между электронными состояниями различной мультиплетности. Эти два процесса известны соответственно как флуоресценция и фосфоресценция. После того как произошло излучение энергии в виде света, реагирующее вещество уже не является возбужденным и фотохимическая реакция не происходит.
Возбужденные состояния могут также тушиться. Тушение является по существу таким же физическим процессом, как и сенсибилизация, но слово «тушение» используют, когда фотовозбужденное состояние реагирующей молекулы дезактивируется в результате передачи ее энергии другой молекуле в растворе. Это вещество называют тушителем.
Наконец, может происходить безизлучательная дезактивация возбужденного состояния молекулы. Так называют процесс передачи энергии возбужденного состояния окружающим молекулам в виде колебательной (термической) энергии без излучения света.
Типы процессов, которые могут происходить после фотохимического возбуждения, приведены на рис. 7.
В силу существования этих конкурирующих процессов не каждая возбужденная молекула вступает в фотохимическую реакцию. Отношение числа реагирующих молекул к числу возбужденных молекул называют квантовым выходом. Этот выход служит мерой использования поглощения света для образования продукта реакции. Квантовый выход, равный 1, означает, что каждая возбужденная молекула (число их равно числу квантов поглощенного света) превращается в продукт. Если квантовый выход 0,01, то только одна из ста возбужденных молекул претерпевает фотохимическую реакцию. Квантовый выход может меняться в широких пределах в зависимости от строения реагирующих веществ и условий реакции. Квантовый выход больше 1 наблюдается при механизме, в котором одно фотовозбуждение может привести к образованию более чем одной молекулы продукта.

Рисунок 7 Диаграмма энергетических уровней и обобщение фотохимических процессов.
Например, квантовый выход может быть очень большим в цепных реакциях, в которых одно фотовозбуждение инициирует цепь реакций, приводящих к большому числу молекул продукта на одну стадию инициирования.
Химические реакции фотовозбужденных молекул представляют интерес в основном по трем причинам.
1) Возбужденные состояния имеют большой запас энергии и поэтому могут вступать в реакции, которые должны быть сильно эндотермичными, если бы они инициировались из основного состояния.
2) Заселение антисвязывающей орбитали в возбужденном состоянии позволяет осуществлять химические превращения, невозможные с электронной точки зрения для частиц в основном состоянии.
3) Спин переходного состояния является третьей переменной. В фотохимической реакции может участвовать как синглетное, так и триплетное состояния, тогда как в большинстве термических процессов участвуют только синглетные частицы. Поэтому возможно образование интермедиатов, которые недоступны в условиях термической активации.
Правила Вудворда – Гофмана предсказывают, что фотохимические реакции противоположны термическим реакциям: что разрешено фотохимически, то запрещено термически, и наоборот. Физической основой этой взаимодополняющей связи является то, что высокий барьер, связанный с запрещенными термическими реакциями, создает возможность для сильного взаимодействия частиц в основном и возбужденном состояниях, а это взаимодействие необходимо для эффективной фотохимической реакции.
Кетоны реагируют в возбужденном n – π*-состоянии. При возбуждении электрон с несвязывающей орбитали кислорода переходит на антисвязывающую π-орбиталь карбонильной группы. Сначала возникает синглетное состояние, но затем может происходить интеркомбинационная конверсия с переходом в триплет. Для насыщенных кетонов синглетное состояние лежит на 80–85 ккал/моль выше основного состояния. Триплетное состояние на 75–80 ккал/моль выше основного. Для формальдегида структуры первого возбужденного синглетного состояния S1 и триплетного состояния Т1 можно описать на основании спектральных данных. В обоих возбужденных состояниях молекула имеет пирамидальное строение, связь С–О растянута и дипольный момент уменьшен до 1,56D по сравнению с 2,34 D для основного состояния. Уменьшение дипольного момента соответствует перемещению электронной плотности с орбитали, локализованной на кислороде, на орбиталь, принадлежащую и углеродному атому.
Альтернативное возбужденное состояние, возможное для карбонильных соединений, возникает в результате перемещения связывающего электрона на антисвязывающую π*-орбиталь. Это π–π*-переход, чаще всего он происходит, когда кетонная группа сопряжена с обширной системой π-связей.
Для возбужденных состояний нельзя написать структуры Льюиса, такие как используют для описания химического строения основных состояний. Вместо этого, как правило, отмечают звездочкой обычную структуру карбонильной группы и, если возможно, дополняют информацией о мультиплетности возбужденного состояния:
[Н2С=О]* 3[Н2С=0]* 1[Н2С=0]*
возбужденное возбужденное возбужденное
состояние, состояние, состояние,
мультиплетность триплетное синглетное
не определена
