
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
Дипольный момент
Одним из свойств молекулы является наличие дипольного момента, возникающего при разделении зарядов. Измерить дипольный момент каждой связи в молекуле невозможно. Можно измерить только суммарный дипольный момент молекулы, который является векторной суммой моментов связей. Эти индивидуальные моменты одинаковы в разных молекулах. В некоторых случаях дипольные моменты связей могут быть значительными, но дипольный момент молекулы оказывается нулевым из-за взаимной компенсации индивидуальных моментов благодаря общей симметрии молекулы.
Индуктивный эффект и эффект поля
Связь С–С в этане не полярная, так как она соединяет два эквивалентных атома, однако в хлорэтане ситуация иная, связь С–С поляризована благодаря наличию электроотрицательного атома Сl. В действительности такая поляризация является результатом двух эффектов.
Некоторое понижение электронной плотности у атома углерода, соседнего с более электроотрицательным атомом хлора, частично компенсируется оттягиванием в его сторону электронов С–С связи, что приводит к его поляризации и возникновению частичного положительного заряда на другом атоме углерода. Такую поляризацию связи называют индуктивным эффектом. Индуктивный эффект передается по -связям и быстро уменьшается от одной связи к другой.
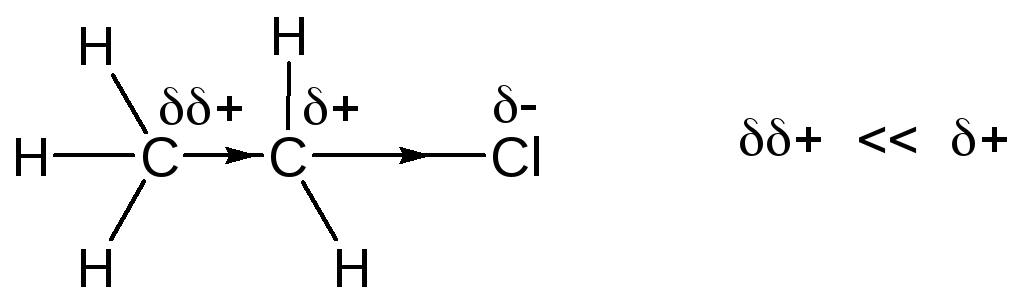
Другой эффект действует не через связи, а непосредственно через пространство или молекулы растворителя, его называют эффектом поля. Часто очень трудно разделить эти два эффекта, но в некоторых случаях это было сделано, при этом, как правило, исходили из того, что эффект поля зависит от геометрии молекулы, а индуктивный эффект зависит от природы связей. Например, в изомерах А и В индуктивный эффект атомов хлора одинаков, и, поскольку между атомом хлора и группой СО2Н находятся одни и те же связи, а эффекты поля различны, так как атомы хлора в А находятся ближе к группе СО2Н. В этом примере индуктивный эффект влияет одинаково в обоих соединениях, а различие в кислотности можно объяснить только эффектом поля. Эффект поля и индуктивный эффект часто объединяют и называют полярным эффектом.

Функциональные группы и атомы по их полярному эффекту разделяют на две группы:
1. Группы или атомы, которые оттягивают электронную плотность сильнее водорода (электронноакцепторные группы). Они проявляют отрицательный полярный эффект, обозначаемый (- I).
2. Группы или атомы, которые оттягивают электронную плотность слабее водорода (электроннодонорные группы). Они проявляют положительный полярный эффект, обозначаемый (+ I).
К электроннодонорным группам относятся группы, несущие отрицательный заряд (но не все), например, СО2-, атомы с низкой электроорицательностью (Si, металлы) и алкильные группы, остальные группы являются электронноакцепторными.
Характеристики связей
Характеристиками связи являются энергия, длина, дипольный момент, валентный угол.
Длина связи. Длина связи – расстояние между составляющими ее атомами. Методы определения длины связей: рентгеноструктурное исследование монокристаллов, дифракция электронов для газообразных веществ, спектроскопические методы (ИК, ЯМР). Расстояние между атомами колеблется, поэтому за длину связи принимают среднее значение расстояния между ядрами; оно зависит от природы атомов и гибридного состояния. Длины связей одного типа в различных соединениях удивительно постоянны и различия обычно не превышают 1 %, например, длина связи С–С (sp3-sp3) в различных соединениях приведена в табл. 2. Длины связей некоторых наиболее важных типов даны в табл. 3.
Таблица 2 Длины связи СС (sp3-sp3) в различных соединениях
|
Соединение |
Длина связи, Å |
|
Сn(алмаз) |
1,544 |
|
С2Н6 |
1,5324 |
|
С2Н5Сl |
1,5495 |
|
С3Н8 |
1,532 |
|
Цикло-С6Н12 |
1,540 |
|
t-С4Н9Сl |
1,532 |
|
н-С4Н10 н-С7Н16 |
1,53 1,534 |
|
i-С4Н10 |
1,535 |
Таблица 3 Длины различных типов связей (средние значения).
|
Тип связи |
Длина, Å |
Типичные соединения |
|
C-C sp3-sp3 |
1,54 |
Этан |
|
sp3-sp2 |
1,50 |
Ацетальдегид, толуол, пропилен |
|
sp3-sp |
1,46 |
Ацетонитрил, пропин |
|
sp2-sp2 |
1,48 |
Бутадиен, дифенил |
|
sp-sp |
1,38 |
Цианоацетилен, бутадиин |
|
C=C sp2-sp2 |
1,34 |
Этилен |
|
sp2-sp |
1,31 |
Кетен, аллены |
|
sp-sp |
1,20 |
Ацетилен
|
Как видно из табл. 3, чем больше s-характер орбиталей атомов углерода, тем короче связь между ними.
Валентные углы. Углы между связями зависят от природы атомов и гибридного состояния. В sp3-гибридизированных атомах углы должны равняться 109° 28'. Однако это соблюдается только в тех случаях, если атом углерода связан с четырьмя одинаковыми лигандами, в остальных случаях наблюдаются отклонения. Например, углы С–С–С в алканах равны примерно 110-112°. То же самое касается систем с sp2- и sp-гибридным атомами (идеальные значения углов равны соответственно 120° и 180°).
Энергия связи. Существует два определения энергии связи. Энергию, необходимую для расщепления молекулы на отдельные радикалы (для двухатомных молекул на атомы), называют энергией диссоциации и обозначают D. Величина D имеет строгий физический смысл, но ее неудобно использовать в анализе реакционной способности молекул. Энергию связи (обозначают Е) определяют как среднее значение от значений диссоциации всех связей молекулы типа АВn (для молекул, где все связи равноценны). Для прочих молекул энергию связи рассчитывают по эмпирически выведенным уравнениям, исходя из суммы значений величины D и значения величины Е для связей соответствующих атомов в молекулах типа АВn. Однако в таких расчетах получают величину, не имеющую строгого физического смысла, так как не существует способов определения того, какая часть энергии диссоциации соответствует той или иной связи. Например, если рассчитать энергию связи углерод – углерод в молекулах этана и пропана, исходя из энергии связи углерод – водород в молекуле метана и энергий диссоциации этана и пропана (эта энергия рассчитывается очень точно, исходя из теплот сгорания соответствующих углеводородов), то получаются разные значения. Поэтому в анализе свойств веществ используют средние значения энергии связи для данного типа связи. Известны также некоторые закономерности для энергии связи.
Существует определенная зависимость между длиной связи и ее энергией. Чем связь короче, тем она прочнее.
При движении по периодической таблице сверху вниз прочность связи уменьшается.
Кратные связи короче и прочнее. -Связь прочнее -связи.
Энергия связи между однотипными атомами примерно одинакова.
