
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
Перегруппировки
При перегруппировках происходит перемещение группы от одного атома к другому в пределах одной молекулы. Обычно осуществляется 1,2-сдвиг, когда перемещение идет к соседнему атому. Мигрирующая группа W может перемещаться со своей электронной парой. Такие перегруппировки называются нуклеофильными или анионотропными, а мигрирующая группа рассматривается как нуклеофил. Известны также перегруппировки, когда мигрирующая группа перемещается без электронной пары. Такие перегруппировки называются электрофильными, или катионотропными. Реже встречаются перегруппировки, в которых мигрирующая группа W перемещается с неспаренным электроном, они называются свободнорадикальными.
Нуклеофильные 1,2-сдвиги встречаются намного чаще, чем электрофильные или свободнорадикальные. Причину этого можно понять, рассматривая переходные состояния таких реакций как структуру, в которой два электрона связи A–W перекрываются с орбиталью атома В. Перекрывание этих орбиталей в переходном состоянии дает три новые орбитали: одну связывающую и две вырожденные разрыхляющие.

В нуклеофильной перегруппировке электроны занимают только связывающую орбиталь, поэтому переходное состояние характеризуется низкой энергией. В свободнорадикальной и электрофильной перегруппировках соответственно три и четыре электрона, и соответственно один или два из них вынуждены занимать разрыхляющие орбитали и энергия переходного состояния становится от этого выше.
Нуклеофильные перегруппировки
Нуклеофильные перегруппировки обычно включают три стадии, из которых собственно миграцией является вторая. Первая стадия – образование системы со свободным секстетом электронов – карбокатиона, карбена или нитрена.
Используют различные методы получения карбокатионов, карбенов и нитренов.
Например:

Вторая стадия – миграция атома или группы со своей электронной парой к атому с секстетом электронов.
Третья стадия. После миграции обязательно возникает новый открытый секстет, поэтому необходима следующая стадия, при которой будет происходить образование октета электронов при этом атоме. Это может быть присоединение нуклеофила (перегруппировка с замещением) или отщепление протона (перегруппировка с элиминированием). Хотя этот механизм является трехстадийным, на практике часто два или три превращения могут протекать одновременно. Например:

Здесь вторая и третья стадии протекают одновременно.
Свободнорадикальные перегруппировки
Свободнорадикальные 1,2-миграции встречаются довольно редко. Они протекают в три стадии: сначала генерируется радикал, затем следуют миграция и стабилизация вновь образующегося радикала. В свободнорадикальных перегруппировках легче мигрируют арильные и винильные группы. При этом интермедиат не содержит неспаренного электрона на трехчленном цикле:
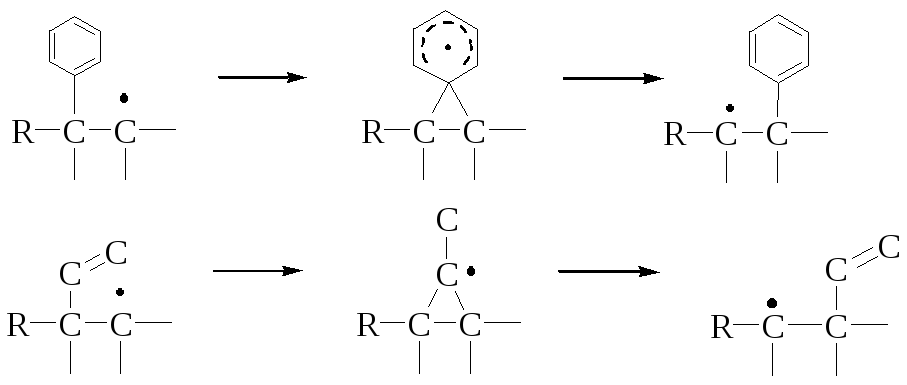
Электрофильные перегруппировки встречаются еще реже, чем нуклеофильные или свободнорадикальные. Механизм электрофильных перегруппировок включает образование карбаниона с последующей миграцией и стабилизацией.
Некоторые важнейшие перегруппировки
Реакция Вагнера – Меервейна
При обработке спиртов кислотами обычно происходит элиминирование или замещение, но в некоторых случаях при наличии у -атома алкильных или арильных групп эти реакции сопровождаются перегруппировкой.

Обычно такие перегруппировки наблюдаются в соединениях, для которых SN затруднено. Такой перегруппировке подвергаются не только спирты, но и некоторые другие соединения, например олефины и даже алканы в присутствии сильных кислот. Интересно отметить, что все предельные трициклические алканы, содержащие десять атомов углерода, при нагревании с AlCl3 перегруппировываются в адамантан, а содежащие четырнадцать атомов углерода – в диадамантан.
Пинаколиновая перегруппировка
При обработке вициальных диолов кислотой может происходить перегруппировка с образованием альдегидов или кетонов. Механизм реакции – нуклеофильный 1,2-сдвиг.

Часто, если R1, R2, R3 и R4 различаются, то образуются смеси продуктов. Если один из радикалов протон, могут получаться альдегиды. Обычно образованию альдегидов способствуют мягкие условия реакции и слабые кислоты, а образованию кетонов – жесткие условия и сильные кислоты.
Перегруппировки, сопровождающиеся расширением и сужением цикла
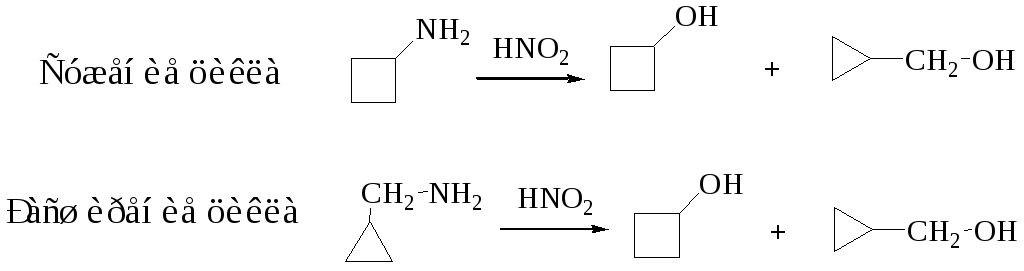
Первая реакция носит название перегруппировки Демьянова. Расширение цикла наблюдается для 3–8-членных циклов, но лучшие результаты достигаются для малых циклов. Сужение наблюдается для 4-, 6-, 7- и 8-членных циклов, пятичленные циклы не сужаются. Механизм реакции 1,2-нуклеофильный сдвиг в карбокатионе.

Перегруппировки альдегидов и кетонов при действии кислот

Этой реакцией альдегиды можно превратить в кетоны, а кетоны – в другие кетоны. Для реакции было предложено два механизма.
Первый включает два последовательных 1,2-нуклеофильных сдвига:

Второй механизм включает образование протонированного эпоксида в качестве интермедиата и 1,2-нуклеофильный сдвиг радикала R:

Опыты с меткой 14С показали, что в разных случаях реализуется первый или второй механизм либо оба механизма одновременно.
Бензильная перегруппировка
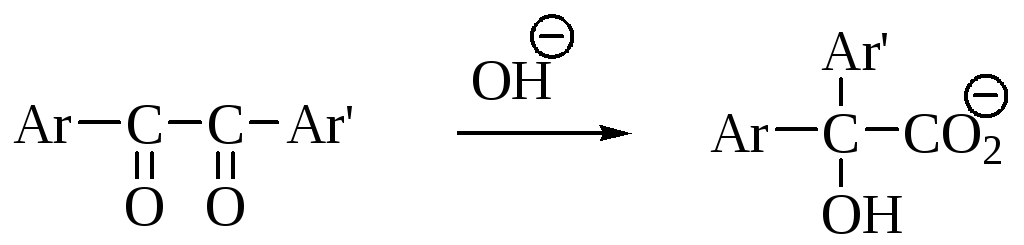
При обработке основаниями -дикетоны дают соли -гидроксикислот. Предполагается механизм, включающий 1,2-нуклеофильный сдвиг.

Перегруппировка Фаворского

Механизм обычной перегруппировки не включает истинной миграции.

Механизм доказан с помощью метки 14С.

Положения 1 и 2 оказались меченными в равной мере, что свидетельствует о том, что в реакции должен участвовать симметричный интермедиат, каким является циклопропанон.
В тех случаях, когда отсутствует протон в -положении к карбонилу, перегруппировка идет по другому механизму, включающему истинную миграцию каторая называется семибензильной перегруппировкой.

Синтез Арндта-Эйстерта
Синтез представляет собой гомологизацию кислот и протекает по схеме:
![]()
Собственно миграция протекает на второй стадии и носит название перегруппировки Вольфа.

Гомологизация альдегидов и кетонов
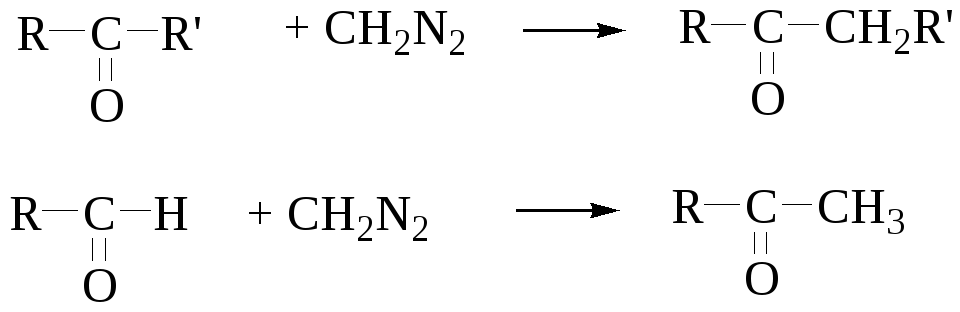
Механизм реакции включает 1,2-нуклеофильный сдвиг, протекающий без участия карбена.
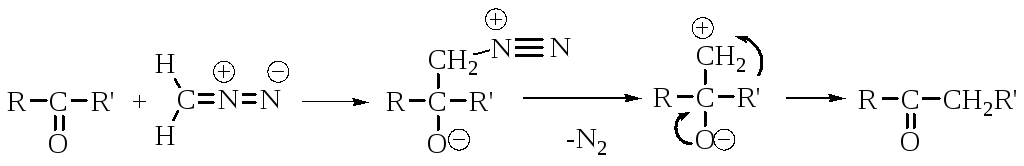
В этой реакции можно выделить промежуточный продукт – бетаин или побочный – оксиран.

Перегруппировки Гофмана, Курциуса, Лоссена
Это родственные перегруппировки которые включают образование из различных субстратов нитрена, в дальнейшем перегруппировывающегося в изоционаты.
![]()

Перегруппировка Бекмана
Реакция заключается в превращении оксимов в амиды при действии кислот.

Миграция осуществляется в протонированном субстрате, причем мигрирующая группа всегда находится в анти-положении к ОН-группе.

Перегруппировка Байера-Виллигера
Реакция заключается в окислении кетонов надкислотами с образованием соответствующих сложных эфиров.
![]()
Реакция протекает по следующей схеме:

Перегруппировки гидропероксидов
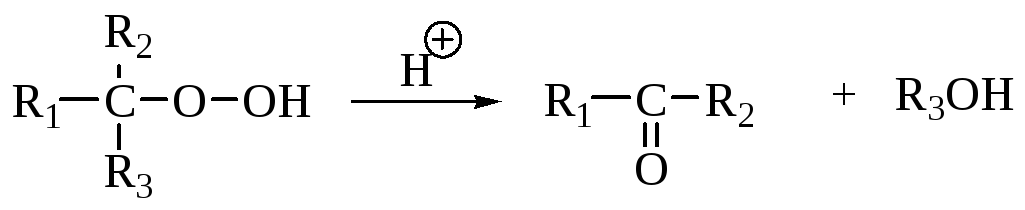
Механизм включает истинную миграцию, сопровождающуюся расщеплением связи кислород-кислород аналогично реакции Байера – Виллигера.

