
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
Нуклеофильное замещение у аллильного атома углерода
Аллильные субстраты особенно легко вступают в реакции SN, т. к. образующийся на первой стадии карбокатион стабилизирован резонансом. Резонансом объясняется и наблюдаемая аллильная перегруппировка при проведении реакции в условиях, способствующих механизму SN1.

Замещение у аллильного атома углерода может протекать и по механизму SN2. Обычно перегруппировка в этом случае не наблюдается. Исключение составляет замешение в субстратах, имеющих в -положении к нуклеофилу заместители, создающие стерические затруднения. В этом случае при механизме SN2 образуется преимущественно продукт аллильной перегруппировки.

Нуклеофильное замещение у тригонального атома углерода
Замещение у тригонального атома углерода, связанного с атомами О, N, S
Замещение чаще всего идет по так называемому тетраэдрическому механизму, включающему две стадии:
образование тетраэдрического интермедиата
 ;
;
отщепление нуклеофуга

Реакция может идти при кислотном, основном катализе или без катализатора.
При проведении реакции в условиях кислотного катализа возможны дополнительно предварительная стадия протонирования приводящая к активации карбонильного соединения и заключительная стадия депротонирования.

Проведение реакции в условиях основного катализа позволяет активировать нуклеофильную частицу:

Реакция возможна без катализатора если субстрат или нуклеофил достаточно активны. Реакция идет по схеме:

Доказательства тетраэдрического механизма.
Имеются кинетические доказательства: процесс описывается уравнением первого порядка и по реагенту и по субстрату.
В очень сильнокислых растворах может осуществляться мономолекулярный механизм, включающий образование иона ацилия:

Нуклеофильное замещение у винильного атома углерода
В случае винильного субстрата тетраэдрический механизм реализуется с трудом, так как в интермедиате отрицательный заряд должен быть локализован на атоме углерода.

Этот механизм имеет место в субстратах типа Z–CH=CH–X, где Z – электроноакцепторная группа.
Замещение у винильного атома углерода, протекающее по механизмам SN2 и SN1, тоже очень редко.

Как видно из схемы, в случае механизма SN2 имеются стерические трудности для атаки нуклеофилом с тыльной стороны к нуклеофугу. В переходном состоянии происходит переход от sp2-гибридизированного атома углерода к sp-гибридизированному, что создает дополнительные стерические трудности. Следствием этих причин является очень низкая реакционная способность винильных субстратов в реакциях SN2.
В случае механизма SN1 должен образовываться нестабильный карбокатион, поэтому винильные субстраты малореакционноспособны и в реакциях SN1.

Чаще всего замещение у винильного атома протекает по механизму, состоящему из двух реакций: присоединения и отщепления (механизм АЕ).

Нуклеофильное замещение в ароматических субстратах
Известно четыре основных механизма ароматического нуклеофильного замещения.
1. Механизм, аналогичный тетраэдрическому механизму, обозначаемый как SNAr, включает две стадии:
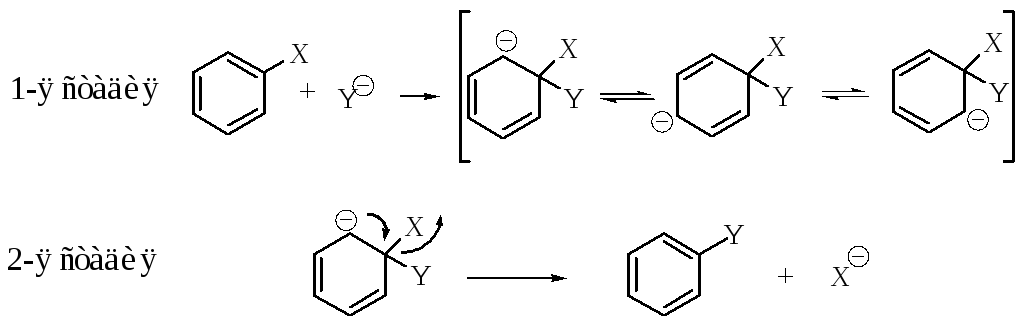
Обычно первая стадия лимитирующая. Наиболее убедительное доказательство механизма SNAr – выделение интермедиата в некоторых реакциях:

2. Мономолекулярный механизм SN1Ar аналогичен алифатическому SN1 и включает две стадии, первая стадия обычно лимитирующая.

Этот механизм характерен для реакции солей диазония. Доказательством механизма SN1Ar является то, что скорость реакции описывается уравнением с первым порядком по субстрату и первым общим порядком. Кроме того, введение в реакционную смесь галогенов приводит к образованию арилгалогенидов, но скорость реакции не зависит от их концентрации.
3. Ариновый механизм. Этот механизм включает образование дегидробензола и по сути включает две реакции: отщепление и присоединение.

Доказательство аринового механизма было получено с помощью меченного изотопами субстрата
![]()
Соотношение двух изотопов 1:1. Кроме того, с арилгалогенидами, имеющими два орто-заместителя у уходящей группы, реакция не должна идти и не идет.
4. Свободнорадикальный ароматический механизм SRN1 включает три основные стадии: образование радикалов, роста цепи и обрыва цепи
![]()

