
- •Локализованная химическая связь Атомные орбитали
- •Молекулярная орбиталь
- •Методы описания локализованной химической связи
- •Гибридизация
- •Кратные связи
- •Электронная структура молекул. Структуры Льюиса
- •Электроотрицательность
- •Дипольный момент
- •Индуктивный эффект и эффект поля
- •Характеристики связей
- •Типы химических связей
- •Делокализованная химическая связь
- •Правила резонанса
- •Типы молекул с делокализованными связями
- •Ароматичность
- •Резонансный эффект
- •Основы стереохимии Введение
- •Энантиомерия
- •Диастереомерия
- •Динамическая стереохимия
- •Прохиральность
- •Кислоты и основания
- •Теория Бренстеда
- •Кислоты и основания Льюиса
- •Карбокатионы, карбанионы, свободные радикалы, карбены и нитрены
- •Карбокатионы
- •Реакции карбокатионов
- •Влияние различных факторов на устойчивость карбокатионов
- •Карбанионы
- •Реакции карбанионов
- •Свободные радикалы
- •Устойчивость свободных радикалов
- •Карбены
- •Реакции карбенов
- •Нитрены
- •Механизмы реакций и методы их установления
- •Типы механизмов реакций по способу разрыва связей
- •Типы реакций
- •Условия протекания реакций
- •Кинетический и термодинамический контроль реакции
- •Методы установления механизмов реакций
- •Кинетические изотопные эффекты
- •Реакции нуклеофильного замещения
- •Замещение у алифатического атома углерода
- •Механизмы реакций нуклеофильного замещения у алифатического атома углерода
- •Нуклеофильное замещение у аллильного атома углерода
- •Нуклеофильное замещение у тригонального атома углерода
- •Нуклеофильное замещение в ароматических субстратах
- •Влияние различных факторов на реакционную способность в реакциях нуклеофильного замещения
- •Электрофильное замещение
- •Механизмы алифатического электрофильного замещения
- •Важнейшие реакции алифатического электрофильнорго замещения
- •Влияние различных факторов на реакционную способность в реакции se
- •Ароматическое электрофильное замещение
- •Реакционная способность и ориентация в реакциях ароматического электрофильного замещения
- •Соотношение орто- и пара-замещенных продуктов
- •Ориентация в бензольных кольцах, содержащих более одного заместителя
- •Свободнорадикальное замещение
- •Механизмы реакций свободнорадикального замещения
- •Механизмы реакций с ароматическими субстратами
- •Участие соседних групп в свободнорадикальных реакциях
- •Реакционная способность в реакциях радикального замещения
- •Реакции элиминирования
- •Механизмы - элиминирования
- •Ориентация двойной связи
- •Реакционная способность в реакциях элиминирования
- •Пиролитическое элиминирование
- •Ориентация двойной связи при пиролитическом элиминировании
- •Присоединение к кратным связям углерод–углерод
- •Электрофильное присоединение Механизмы электрофильного присоединения
- •Нуклеофильное присоединение
- •Свободнорадикальное присоединение
- •Ориентация и реакционная способность в реакциях присоединения
- •Перециклические реакции
- •Реакции циклоприсоединения
- •Элетроциклические реакции
- •Перегруппировки
- •Нуклеофильные перегруппировки
- •Свободнорадикальные перегруппировки
- •Некоторые важнейшие перегруппировки
- •Сигматропные перегруппировки
- •Метод Мебиуса – Хюккеля
- •Наиболее важные сигматропные перегруппировки
- •Бензидиновая перегруппировка
- •Фотохимия Общие положения
- •Некоторые типы наиболее важных фотохимических реакций
- •Список рекомендуемой литературы
- •Каюков Яков Сергеевич
Кинетические изотопные эффекты
В основе кинетического
изотопного эффекта лежит тот факт, что
прочность связи между двумя атомами
зависит от их массы. Поэтому замена
атома на его изотоп приводит к тому, что
прочность связи немного, но все же
заметно изменяется. Сильнее всего этот
эффект выражается при замене протона
на дейтерий, т. к. в этом случае относительная
разность масс составляет 100 %. Связь С–D
прочнее связи С–Н, поэтому, если в
переходном состоянии эти связи
затрагиваются, дейтерий замещенные
вещества реагируют медленнее. Наблюдаемое
при этом различие в скорости реакции
называют кинетическим изотопным эффектом
и выражают соотношением
![]() .
Различают первичный и вторичный изотопный
эффект.
.
Различают первичный и вторичный изотопный
эффект.
Первичный изотопный эффект
Значение первичного эффекта зависит от следующих факторов:
а) от природы связи: Например, эффект связи С–Н и N–Н различен;
б) температуры. Чем выше температура, тем менее селективно протекает реакция в отношении Н, D изомерии;
в) того, насколько затрагивается рассматриваемая связь в переходном состоянии.
Примеры использования первичного кинетического изотопного эффекта.
а) Скорость бромирования ацетона не зависит от концентрации брома.
![]()
Наблюдаемый
изотопный эффект
![]() около
7 подтверждает предположение, что
лимитирующей стадией является
таутомеризация ацетона.
около
7 подтверждает предположение, что
лимитирующей стадией является
таутомеризация ацетона.
б) Наибольший изотопный эффект достигается при симметричном распределении водорода в переходном состоянии, поэтому много выводов можно сделать, изучая изотопный эффект для серии реакций. Например, в реакции Е2:


Чем хуже нуклеофуг, тем менее симметричное переходное состояние и меньше kH/kD. Таким образом, при исследовании первичного изотопного эффекта, можно изучать нуклеофильные и электрофильные свойства атомов и групп, а также кислотность и основность.
в) Для кислотоно-основных реакций
АН + В А- + ВН+
максимальный изотопный эффект достигается, когда pKa(AH) - pKa(BH+)=0, во всех остальных случаях, когда pKa0, наблюдается меньший изотопный эффект.
В реакции
![]()
изучалась зависимость kH/kD от соотношения Н2О, ДМСО. Найдено:

Таким образом при изучении kH/kD прослеживается зависимость влияния среды (соотношения Н2О и ДМСО) на основность КОН.
г) В реакции Чичибабина

не обнаружено изотопного эффекта при замене Н на D во втором и третьем положениях. Следовательно, на стадии, определяющей скорость реакции, не происходит разрыва связей ни С(2)–Н, ни С(3)–Н. Эти данные исключают механизм SArN

и подтверждают механизм АЕ, причем лимитирующей будет первая стадия

Таким образом, и из отсутствия первичного изотопного эффекта можно сделать некоторые выводы о механизме реакции.
Интерпретация первичного изотопного эффекта иногда усложняется из-за туннельного эффекта, который со всей стороны допускает обратные выводы о структуре переходного состояния. Туннельный эффект проявляется в необычно большом kH/kD>7, понижением соотношения AH/AD (A определяется из уравнения lgk = lgA - Ea/2,30RT) и в сильной зависимости kH/kD от температуры.
Вторичный изотопный эффект.
При изучении реакции
![]()
были получены такие данные по изотопному эффекту соответствующих дейтериевых производных А, В и С

Изотопный эффект в А соответствует первичному изотопному эффекту в других реакциях Е2. В случае В и С связи С–Н (D) не участвуют непосредственно в реакции и, тем не менее, оказывают влияние на скорость реакции. Такой эффект называется вторичным изотопным эффектом. Как и первичный, вторичный изотопный связан с тем, что связь С–D прочнее связи С–Н. Прочность связи, не участвующей непосредственно в реакции, может различным образом влиять на скорость реакции, из чего могут быть сделаны заключения о переходном состоянии.
1. Изменения в гибридизации
При описанном выше -элиминировании два атома углерода, которые в исходном состоянии имеют sp3-гибридизацию, превращаются в ходе реакции в sp2-гибридизированные атомы углерода. Это изменение гибридизации частично наступает в переходном состоянии, а связи С–D затрудняют этот процесс. То, что изменение гибридизации действительно оказывает влияние на kH/kD, показывает следующий эксперимент.

В обоих случаях возникает один и тот же катион С, однако изменение гибридизации имеет место только в А, в соответствии с чем находится и экспериментально найденный изотопный эффект. Подобная интерпретация требует, чтобы реакции, в которых происходит изменение гибридизации с sp2 на sp3, должен наблюдаться эффект kH/kD, называемый обратным. Это действительно имеет место, например, в реакции
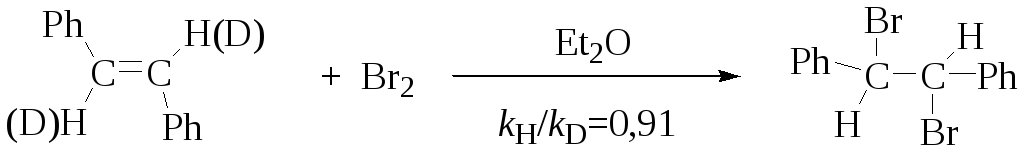
2.Гиперконъюгация.
Связь С–D прочнее связи С–Н и в меньшей степени подвержена сопряжению с р- или -орбиталями, поэтому в реакциях, где переходное состояние имеет гиперконъюгацию, наблюдается вторичный изотопный эффект. Например, реакция сольволиза трет-амилхлорида в 80 % этиловом спирте.

3. Стерические эффекты. Группа СD3 занимает меньший обьем по сравнению с СН3, что является причиной вторичного эффекта во многих реакциях. Пример реакции, где стерический эффект действует в чистом виде, представлен рацемизацией следующих соединений.

