
- •Законы, регулирующие обращение лекарственных средств в рф, и их характеристика
- •Государственный контроль в сфере обращения лекарственных средств в рф
- •Понятие качества лекарственных средств и определяющие его факторы.
- •Пути обеспечения качества лекарственных средств.
- •Перечислите и охарактеризуйте основные требования к производству лс в соответствии с gmp.
- •Каковы различия в понятиях «Контроль качества» и «Система обеспечения качества лс»?
- •Преимущества перехода отечественных фармацевтических пред-приятий на выпуск продукции в соответствии с правилами gmp для производителей и потребителей.
- •Охарактеризуйте виды отношений при обращении лекарственных средств, которые регулируются фз «Об обращении лекарственных средств»
- •Статус, назначение и характеристика Государственной фармакопеи рф.
- •10. Понятие фармакопейной статьи и ее требования к лекарственному средству. Приведите примеры.
- •Нормативная документация, регламентирующая производство и качество лекарственных препаратов.
- •12. Охарактеризуйте систему стандартов gxp.
- •13. Опишите нормативно–правовую базу лицензирования производства лекарственных средств в рф.
- •14. Перечислите и обоснуйте основные лицензионные требования и условия при осуществлении деятельности по производству лекарственных средств.
- •Глава 8. Производство и маркировка лекарственных средств
- •15. Опишите порядок государственной регистрации лекарственных средств в рф. Охарактеризуйте препараты, подлежащие и не подлежащие государственной регистрации в рф.
- •17. Охарактеризуйте информацию, содержащуюся в регистрационном удостоверении лекарственного препарата. Кем выдается этот документ и на какой срок?
- •18. Что такое гармонизация системы технического регулирования в сфере обращения лекарственных средств?
- •19. Опишите глобальные и региональные механизмы международной гармонизации в сфере обращения лекарственных средств.
- •20. Задачи и пути интеграции России в мировое сообщество в области качества фармацевтической продукции.
- •21. Охарактеризуйте этапы создания лекарственного препарата.
- •22. Охарактеризуйте этапы испытания лекарственного средства.
- •23. Порядок проведения клинических испытаний в рф.
- •24. Как осуществляется регистрация лекарственных средств и в соответствии с какими нормативными документами?
- •25. Охарактеризуйте правила лабораторной практики (glp).
- •26. Дайте развернутую характеристику правил клинической практики (gсp).
- •27. Перечислите основные требования правил gmp к производству лекарственных средств.
- •28. Приведите различия и общие принципы правил gmp, gcp и glp.
- •29. Требования к качеству лекарственных веществ, вспомогательных веществ и материалов.
- •30. Требования gmp к процессу производства готовых лекарственных препаратов.
- •31. Способы очистки и стерилизации воздуха. Механизмы осаждения частиц аэрозоля на волокнистых фильтрах. Классификация воз-
- •1822 И гост р 51251-99:
- •32. Объекты, документация и методы самоинспекции.
- •33. Принципы управления рисками для качества лекарственных средств.
- •34. Основные правила планировки производственных зданий в соот-ветствии с gmp.
- •35. Виды производственных зон фармацевтического предприятия и требования к ним.
- •36. Требования gmp к оборудованию для производства лекарствен-ных средств.
- •37. Предотвращение перекрестного загрязнения при производстве биотехнологических препаратов.
- •38. Виды стандартных операционных процедур в фармацевтическом производстве, принципы создания и содержание.
- •39. Классификация производственных помещений по классам чисто-ты. Требования к эксплуатации и обслуживанию чистых помеще-
- •40. Требования к качеству технологической воды в производстве ле-карственных средств. Методы очистки.
- •41. Критерии отбора персонала при приеме на работу.
- •42. Правила обучения персонала на фармацевтическом предприятии.
- •Обязанности уполномоченного лица:
- •Основные обязанности руководителя производства:
- •3.Основные обязанности руководителя подразделения контроля качества:
- •44. Личная гигиена и обязанности персонала чистых помещений.
- •45. Организация работ по валидации. Этапы валидации. (л.13 с.-7)
- •46. Определение стадий технологического процесса, требующих про-верки при валидации. Документирование валидации технологиче-
- •47. Срок регистрации лекарственного средства закончился. Возможна его дальнейшая реализация? Если да, то, при каких условиях? От- вет обосновать
- •51. Опишите последовательность действий фирмы-разработчика ле-карственного средства при государственной регистрации этого ле- карства.
- •Глава 8. Производство и маркировка лекарственных средств
- •Глава 4. Государственный контроль при обращении лекарственных
- •53. Опишите этапы клинических испытаний лекарственного препара-та и охарактеризуйте каждый из этих этапов.
- •Опишите процесс доклинических испытаний лекарственного пре-
- •Приведите перечень типов лекарственных препаратов, которые подлежат обязательной государственной регистрации и обоснуйте, почему каждый из этих типов включен в этот перечень.
- •Государственной регистрации подлежат:
- •Государственной регистрации не подлежат:
- •Не допускается государственная регистрация:
- •Объясните, почему лекарственные препараты-дженерики зани-мают значительную нишу на лекарственном рынке рф и других стран. Ответ обоснуйте.
- •Создание чистого помещения основано на принципе «комната в комнате». Поясните на примере зоны чистоты класса а, каким об-разом образуется рабочая зона чистого помещения.
- •Предложите и обоснуйте схему использования базовых элементов чистых помещений для операций, представляющих особый риск для качества продукции.
- •Какими приемами достигается обеспечение класса чистого поме-щения? Оцените эффективность ламинарного или турбулентного режимов течения стерильного воздуха в чистой зоне.
- •Предложите и обоснуйте оптимальную схему подбора фильтров очистки и стерилизации воздуха для чистых помещений (зон) клас-
- •Кто является Уполномоченным лицом на фармацевтическом предприятии? Что входит в обязанности этого сотрудника? Кому могут быть, в случае необходимости, переданы его функции?
- •Кем, для чего и в какой форме создаются документы на фармацев-тическом предприятии? Как работник получает информацию о проведении необходимых операций/действий и сообщает об их ре-зультатах?
- •Охарактеризуйте механизмы осаждения твердых частиц на волок-нистых фильтрах. Частицы, какого размера обладают повышенной
-
Нормативная документация, регламентирующая производство и качество лекарственных препаратов.
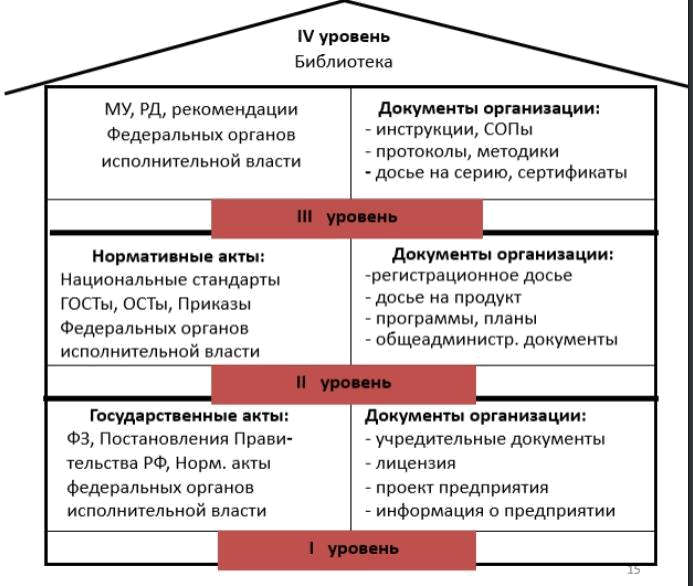
Производство:
-
ФЗ «О техническом регулировании»
-
ФЗ «Об обращении ЛС»
Также:
-
Технологические регламенты.
-
Государственная фармакопея (ГФ).
-
Фармакопейные статьи (ФС).
-
Временные фармакопейные статьи (ВФС).
-
Государственные стандарты (ГОСТ).
-
Отраслевые стандарты (ОСТ).
-
Технические условия (ТУ).
-
Руководящий нормативный документ (РД) – инструкции, методические указания и т. д.
-
Производственные и технологические инструкции.
12. Охарактеризуйте систему стандартов gxp.
GxP - Система надлежащих практик (Good … Practice), система специальных отраслевых стандартов, принятых в мировой фармацевтической отрасли, устанавливающих требования к оборудованию, персоналу, обеспечению и контролю качества, полупродуктам, продуктам, а также результатам деятельности компаний на всех этапах обращения лекарственных средств.
Русский Регистр является единственной в России организацией, имеющей государственную аккредитацию (Федеральная служба по аккредитации РФ) на право сертификации в соответствии со стандартами надлежащих практик
-
GLP - правила доклинических исследований
-
GCP - правила клинических исследований
-
GМP - правила надлежащего производства ЛС
-
GDP – правила оптовой торговли лекарственными средствами
-
GPP – правила розничной торговли лекарственными средствами
-
GSP - правила надлежащего хранения ЛС
-
GRP - правила надлежащего найма на работу с ЛС
13. Опишите нормативно–правовую базу лицензирования производства лекарственных средств в рф.
Лицензирование производства лекарственных средств фармацевтической деятельности осуществляется в соответствии с законодательством Российской Федерации.
Постановление Правительства РФ от 06.07.2012 N 686 (ред. от 20.06.2018) "Об утверждении Положения о лицензировании производства лекарственных средств»
Нормативно-правовая база, регламентирующая предоставление лицензии на фармацевтическую деятельность:
- Федеральный закон № 99 от 04.05.2011 г. «О лицензировании отдельных видов деятельности»;
-
ФЗ от 22.08.2004 г. № 122-ФЗ «О лекарственных средствах»;
- ФЗ от 08.01.1998 г. № 3-ФЗ «О наркотических средствах и психотропных веществах»;
- Постановление Правительства РФ от 06.07.2006 г. № 416 «Об утверждении Положения о лицензировании фармацевтической деятельности» (ред. от 19.07.2007 г.);
- Постановление Правительства РФ от 04.11.2006 г. № 648 «Об утверждении Положения о лицензировании деятельности, связанной с оборотом наркотических средств и психотропных веществ»;
- Постановление Правительства РФ от 06.07.2006 г. № 415 «Об утверждении Положения о лицензировании производства лекарственных средств»;
- Постановление Правительства РФ от 06.07.2005 г. № 438 «О порядке ввоза и вывоза лекарственных средств, предназначенных для медицинского применения»;
-
Приказ Минздрава России от 04.03.2003 г. № 80 «Об утверждении отраслевого стандарта "Правила отпуска (реализации) лекарственных средств в аптечных организациях. Основные положения"»;
-
Приказ МЗСР РФ от 12.02.2007 г. № 110 «О порядке назначения и выписывания лекарственных средств, изделий медицинского назначения и специализированных продуктов лечебного питания».
