- •Законы, регулирующие обращение лекарственных средств в рф, и их характеристика
- •Государственный контроль в сфере обращения лекарственных средств в рф
- •Понятие качества лекарственных средств и определяющие его факторы.
- •Пути обеспечения качества лекарственных средств.
- •Перечислите и охарактеризуйте основные требования к производству лс в соответствии с gmp.
- •Каковы различия в понятиях «Контроль качества» и «Система обеспечения качества лс»?
- •Преимущества перехода отечественных фармацевтических пред-приятий на выпуск продукции в соответствии с правилами gmp для производителей и потребителей.
- •Охарактеризуйте виды отношений при обращении лекарственных средств, которые регулируются фз «Об обращении лекарственных средств»
- •Статус, назначение и характеристика Государственной фармакопеи рф.
- •10. Понятие фармакопейной статьи и ее требования к лекарственному средству. Приведите примеры.
- •Нормативная документация, регламентирующая производство и качество лекарственных препаратов.
- •12. Охарактеризуйте систему стандартов gxp.
- •13. Опишите нормативно–правовую базу лицензирования производства лекарственных средств в рф.
- •14. Перечислите и обоснуйте основные лицензионные требования и условия при осуществлении деятельности по производству лекарственных средств.
- •Глава 8. Производство и маркировка лекарственных средств
- •15. Опишите порядок государственной регистрации лекарственных средств в рф. Охарактеризуйте препараты, подлежащие и не подлежащие государственной регистрации в рф.
- •17. Охарактеризуйте информацию, содержащуюся в регистрационном удостоверении лекарственного препарата. Кем выдается этот документ и на какой срок?
- •18. Что такое гармонизация системы технического регулирования в сфере обращения лекарственных средств?
- •19. Опишите глобальные и региональные механизмы международной гармонизации в сфере обращения лекарственных средств.
- •20. Задачи и пути интеграции России в мировое сообщество в области качества фармацевтической продукции.
- •21. Охарактеризуйте этапы создания лекарственного препарата.
- •22. Охарактеризуйте этапы испытания лекарственного средства.
- •23. Порядок проведения клинических испытаний в рф.
- •24. Как осуществляется регистрация лекарственных средств и в соответствии с какими нормативными документами?
- •25. Охарактеризуйте правила лабораторной практики (glp).
- •26. Дайте развернутую характеристику правил клинической практики (gсp).
- •27. Перечислите основные требования правил gmp к производству лекарственных средств.
- •28. Приведите различия и общие принципы правил gmp, gcp и glp.
- •29. Требования к качеству лекарственных веществ, вспомогательных веществ и материалов.
- •30. Требования gmp к процессу производства готовых лекарственных препаратов.
- •31. Способы очистки и стерилизации воздуха. Механизмы осаждения частиц аэрозоля на волокнистых фильтрах. Классификация воз-
- •1822 И гост р 51251-99:
- •32. Объекты, документация и методы самоинспекции.
- •33. Принципы управления рисками для качества лекарственных средств.
- •34. Основные правила планировки производственных зданий в соот-ветствии с gmp.
- •35. Виды производственных зон фармацевтического предприятия и требования к ним.
- •36. Требования gmp к оборудованию для производства лекарствен-ных средств.
- •37. Предотвращение перекрестного загрязнения при производстве биотехнологических препаратов.
- •38. Виды стандартных операционных процедур в фармацевтическом производстве, принципы создания и содержание.
- •39. Классификация производственных помещений по классам чисто-ты. Требования к эксплуатации и обслуживанию чистых помеще-
- •40. Требования к качеству технологической воды в производстве ле-карственных средств. Методы очистки.
- •41. Критерии отбора персонала при приеме на работу.
- •42. Правила обучения персонала на фармацевтическом предприятии.
- •Обязанности уполномоченного лица:
- •Основные обязанности руководителя производства:
- •3.Основные обязанности руководителя подразделения контроля качества:
- •44. Личная гигиена и обязанности персонала чистых помещений.
- •45. Организация работ по валидации. Этапы валидации. (л.13 с.-7)
- •46. Определение стадий технологического процесса, требующих про-верки при валидации. Документирование валидации технологиче-
- •47. Срок регистрации лекарственного средства закончился. Возможна его дальнейшая реализация? Если да, то, при каких условиях? От- вет обосновать
- •51. Опишите последовательность действий фирмы-разработчика ле-карственного средства при государственной регистрации этого ле- карства.
- •Глава 8. Производство и маркировка лекарственных средств
- •Глава 4. Государственный контроль при обращении лекарственных
- •53. Опишите этапы клинических испытаний лекарственного препара-та и охарактеризуйте каждый из этих этапов.
- •Опишите процесс доклинических испытаний лекарственного пре-
- •Приведите перечень типов лекарственных препаратов, которые подлежат обязательной государственной регистрации и обоснуйте, почему каждый из этих типов включен в этот перечень.
- •Государственной регистрации подлежат:
- •Государственной регистрации не подлежат:
- •Не допускается государственная регистрация:
- •Объясните, почему лекарственные препараты-дженерики зани-мают значительную нишу на лекарственном рынке рф и других стран. Ответ обоснуйте.
- •Создание чистого помещения основано на принципе «комната в комнате». Поясните на примере зоны чистоты класса а, каким об-разом образуется рабочая зона чистого помещения.
- •Предложите и обоснуйте схему использования базовых элементов чистых помещений для операций, представляющих особый риск для качества продукции.
- •Какими приемами достигается обеспечение класса чистого поме-щения? Оцените эффективность ламинарного или турбулентного режимов течения стерильного воздуха в чистой зоне.
- •Предложите и обоснуйте оптимальную схему подбора фильтров очистки и стерилизации воздуха для чистых помещений (зон) клас-
- •Кто является Уполномоченным лицом на фармацевтическом предприятии? Что входит в обязанности этого сотрудника? Кому могут быть, в случае необходимости, переданы его функции?
- •Кем, для чего и в какой форме создаются документы на фармацев-тическом предприятии? Как работник получает информацию о проведении необходимых операций/действий и сообщает об их ре-зультатах?
- •Охарактеризуйте механизмы осаждения твердых частиц на волок-нистых фильтрах. Частицы, какого размера обладают повышенной
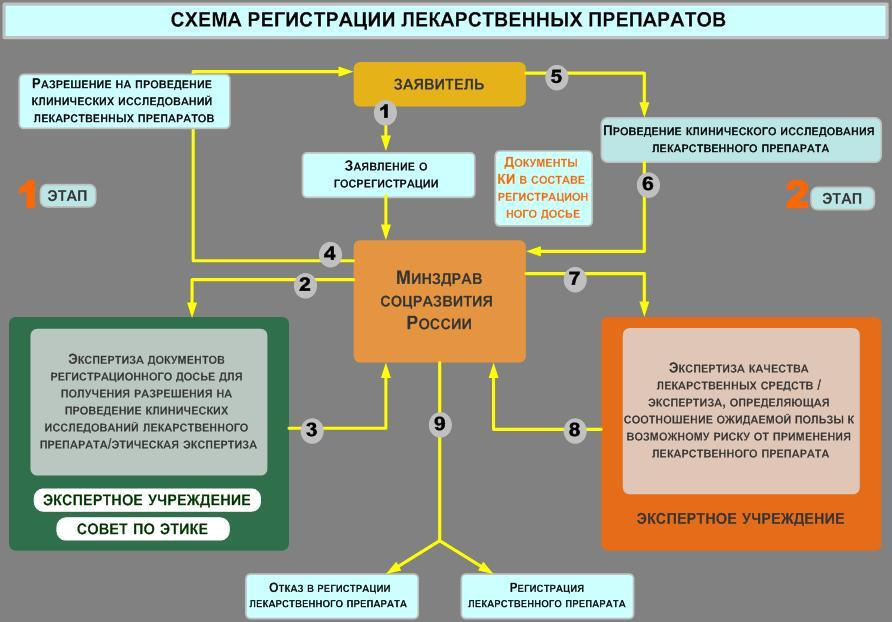
24. Как осуществляется регистрация лекарственных средств и в соответствии с какими нормативными документами?
-
Регистрация лекарственных средств в России является одним из компонентов системы защиты здоровья и жизни населения от небезопасных, неэффективных и некачественных лекарственных средств (ЛС).
-
Регистрация лекарственных средств используется государствами во всех странах мира и осуществляется государственными органами исполнительной власти в области здравоохранения.
-
В соответствии с Главой 6. «Осуществление государственной регистрации лекарственных препаратов» Федерального закона “Об обращении лекарственных средств” от 12.04.2010г. № 61-ФЗ, в Российской Федерации для использования в медицинской практике лекарственных средств (как отечественных, так и зарубежных) необходима их государственная регистрация.
-
Регистрация является одним из важнейших элементов системы защиты здоровья
человека от небезопасных, неэффективных и некачественных ЛС. - Анализ организации процесса регистрации ЛС показал, что структура систем регистрации в разных странах практически универсальна и включает следующие элементы:
-
Государство
-
Заявители - производители ЛС и разработчики
-
Экспертные органы
Регистрация:
-
Включение ЛС в Государственный реестр лек.средств (РЛС)
-
Утверждение инструкции по применению ЛП
Государственной регистрации в РФ подлежат:
• новые лекарственные средства;
• новые комбинации зарегистрированных ранее лекарственных средств;
• лекарственные средства, зарегистрированные ранее, но произведенные в других
лекарственных формах, с новой дозировкой или другим составом вспомогательных ве-ществ;
-
воспроизведенные лекарственные средства
Государственной регистрации не подлежат:
1) лекарственные препараты, изготовленные аптечными организациями, ветеринар-
ными аптечными организациями, индивидуальными предпринимателями, которые имеют лицензию на фармацевтическую деятельность, по рецептам на лекарственные препараты и требованиям медицинских организаций, ветеринарных организаций;
-
лекарственное растительное сырье;
-
лекарственные препараты, приобретенные физическими лицами за пределами территории Российской Федерации и предназначенные для личного использования;
-
лекарственные препараты, предназначенные для экспорта;
-
радиофармацевтические лекарственные препараты, изготовленные непосред-ственно в медицинских организациях в порядке, установленном уполномоченным феде-ральным органом исполнительной власти.
Порядок гос. регистрации ЛС в РФ:
• Государственная регистрация лекарственных препаратов осуществляется соответ-ствующим уполномоченным федеральным органом исполнительной власти в срок, не пре-
вышающий 210 рабочих дней со дня принятия заявления о государственной регистрации лекарственного препарата. В указанный срок включается время, необходимое для повтор-ного проведения экспертизы лекарственных средств и (или) этической экспертизы в соот-ветствии со статьей 25 настоящего Федерального закона.
• Срок государственной регистрации лекарственного препарата исчисляется со дня принятия соответствующим уполномоченным федеральным органом исполнительной вла-сти заявления о государственной регистрации лекарственного препарата с приложением необходимых документов по день выдачи регистрационного удостоверения лекарственно-го препарата.
• Время проведения клинического исследования лекарственного препарата не учи-тывается при исчислении срока его государственной регистрации.
• Государственная регистрация лекарственных препаратов для медицинского приме-нения осуществляется по результатам экспертизы лекарственных средств и этической экспертизы возможности проведения клинического исследования лекарственного препа-рата для медицинского применения (далее - этическая экспертиза).
• Государственная
регистрация лекарственных препаратов
для ветеринарного при-менения
осуществляется по результатам экспертизы
лекарственных средств для ветери-нарного
применения.